Sequential treatment of metastatic colorectal carcinoma
03/2019
MUDr. Eugen Kubala
Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha
SUMMARY
Dissatisfaction with the current state of the complex metastatic colorectal cancer treatment leads to a deeper analysis of the right choice of consecutive treatment line. Metastatic colorectal cancer remains incurable in most cases. We have a variety of cytostatics and biological treatments available. The right choice for the 1st line of treatment, which is crucial for the outcome of the whole treatment, seems to be crucial. The selection is based on knowledge of biological markers of RAS and BRAF and clinical factors. The result of successive lines depends on choosing the correct 1st line. In the 2nd line, anti-angiogenic agents (bevacizumab, ramucirumab and aflibercept) were used. Epidermal growth factor receptor (EGFR) inhibitors do not increase 2nd-line survival. The 3rd line is dependent on the molecular examination of the tumor. Knowing the status of the RAS BRAF mutation determines whether we use anti EGFR antibodies or BRAF and MEK inhibitors. The state of microsatellite stability is critical to the use of immunotherapy (pembrolizumab, nivolumab, and ipilimumab. Proper understanding of the mechanisms of selection of sequential therapy and its de-escalation and re-escalation may lead to prolonged positive treatment outcomes. A significant difference between progression to full treatment or de-escalated treatment, the latter allowing reuse of the substance that was used at the start of treatment, knowledge of the molecular profile of tumors that appears to be essential in the choice of treatment should contribute to the correct management of treatment. In the 1st, 2nd and 3rd line of therapy, the selective pressure of treatment on cell subpopulations of the tumor limits the success of the next treatment line.
Key words
metastatic colorectal carcinoma, sequential treatment, molecular tumor profile
The full article is only available to subscribers
Become a regular subscriber to our Oncological Review...
ÚVOD
Léčba metastazujícího kolorektálního karcinomu dosáhla hranice mediánu celkového přežití 30 měsíců, a to postupy standardní chemoterapie v kombinaci s inhibitory vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF) nebo receptoru epidermálního růstového faktoru (epidermal growth factor receptor, EGFR). Chemoterapie zůstává páteří léčby u pacientů s metastazujícím kolorektálním karcinomem. Její základ tvoří 5-fluorouracil včetně jeho kombinací s dalšími látkami zahrnujících kombinace 5-fluorouracil + leucovorin + oxaliplatina (FOLFOX), 5-FU + leucovorin + irinotecan (FOLFIRI) a 5-fluorouracil + leucovorin + irinotecan + oxaliplatina (FOLFOXIRI) režimy.1-4 Ve 3. a 4. linii léčby se uplatnily regorafenib a trifluridin/tipiracil. Nespokojenost s dosavadními výsledky léčby metastazujícího kolorektálního karcinomu vedla k hledání optimální léčebné sekvence. Mezinárodní doporučení NCCN (The National Comprehensive Cancer Network) a ESMO (European Society for Medical Oncology) stanovila určité sekvence léčebných kombinací, které nepřinesly uspokojivé výsledky. Pětiletého přežití dosáhne 90,1 % pacientů s lokalizovaným kolorektálním karcinomem, ale u pacientů s metastazujícím kolorektálním karcinomem dosáhne pětiletého přežití jen 11,7 % pacientů. Nízká míra přežití u pacientů s metastazujícím kolorektálním karcinomem ukazuje, že současné léčebné postupy jsou nedostatečné. Je nesporné, že prostředky, které vynakládáme na tuto léčbu, nepřinášejí adekvátní výsledky. Je nutné přehodnotit optimální nasazení současně dostupných prostředků, abychom přežití pacientů s metastazujícím kolorektálním karcinomem zlepšili.
Do rozhodovacích procesů volby léčby určitě zasahuje lokalizace nádoru. Ta neodráží jen vlastní lokalizaci, ale spíše genetické změny, které v dané lokalizaci definují kolorektální nádor, a tím určují jeho budoucí chování a odpověď na léčbu. Právě genetická analýza bude hrát v budoucnu důležitou úlohu pro stanovení sekvenční léčby.
VÝZNAM JEDNOTLIVÝCH LINIÍ LÉČBY
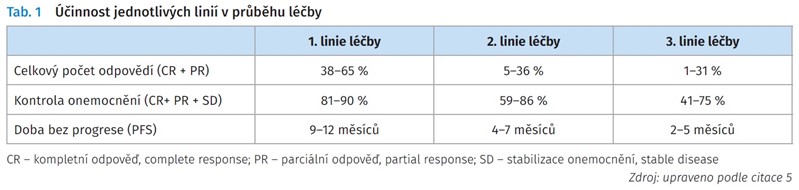
Není pochyb o tom, že nejdůležitější pro budoucí osud pacienta je správná volba 1. linie léčby. V úspěšnosti systémové léčby u metastazujícího kolorektálního karcinomu je klíčová, protože má nejdelší dobu trvání léčby, je nejúčinnější z hlediska přežití bez progrese a je jedinou léčbou, kterou se léčí všichni pacienti. Výsledek účinnosti 1. linie j e rozhodující pro výsledek celé léčby u všech pacientů. Druhá a 3. linie je určena jen pro menší část pacientů. Rozhodování o 2. a 3. linii by mělo také vycházet z úspěšnosti 1. linie (tab. 1).5 Často je rychlý sled léčebných linií důsledkem snížené tolerance z důvodu toxicity použitých léků a brzkého vzniku rezistence na stanovenou léčbu.6,7
PRVNÍ LINIE LÉČBY
O správném způsobu léčby rozhodují klinické faktory a biologické faktory.
Klinické faktory jsou určeny především rozsahem onemocnění. Metastatické postižení jednoho orgánu a jeho rozsah určuje zaměření léčby. Cílem je konverze z metastatického inoperabilního onemocnění na operabilní a dosažení úplného odstranění nádorového onemocnění. U mnohočetného postižení jednoho orgánu nebo postižení více orgánů je hlavním cílem léčby dosažení odpovědi na léčbu a její dlouhodobé trvání. O volbě léčby rozhoduje lokalizace nádoru. To platí hlavně u pacientů s anti-EGFR terapií u wtRAS (divoký typ [wild type] RAS) kolorektálního karcinomu. Pokud je nádor umístěn v levé části tlustého střeva, přináší tato léčba jasný prospěch. U pravostranných nádorů je tomu naopak.8,9
U části pacientů, zvláště starších, kteří nejsou schopni nebo ochotni podstoupit kombinovanou chemoterapii, lze léčbu modifikovat. Použité režimy mohou být bez oxaliplatiny nebo irinotecanu nebo s upravenou dávkou oxaliplatiny v kombinaci s fluoropyrimidiny10 nebo kombinace fluoropyrimidinu a bevacizumabu.11-14
Biologické faktory vycházejí z poznání rozdílů jednotlivých typů nádoru podle genetických změn, které ovlivňují účinnost biologické léčby a imunoterapie u kolorektálního karcinomu.
Přítomnost určitých molekulárních markerů pomáhá určit u metastazujícího kolorektálního karcinomu správnou biologickou léčbu. Ve shodě s těmito poznatky doporučení ESMO a NCCN jsou zásadní pro stanovení léčby v 1. linii testování RAS a BRAF (tab. 2).7,15 Pacienti s přítomností mutované formy RAS nejsou vhodní pro léčbu anti-EGFR protilátkami a jsou doménou anti-VEGF protilátky bevacizumabu. Pacienti s nemutovanou formou RAS jsou vhodní pro léčbu anti-EGFR protilátkami. Ukazuje se, že přítomnost mutace BRAF tento benefit stírá. Tato skupina pacientů je vhodná k tripletové kombinaci s fluorouracilem, leucovorinem, oxaliplatinou a irinotecanem (FOLFOXIRI) plus bevacizumabem. Mutace BRAF je také považována za nepříznivý prognostický faktor.
DRUHÁ LINIE LÉČBY
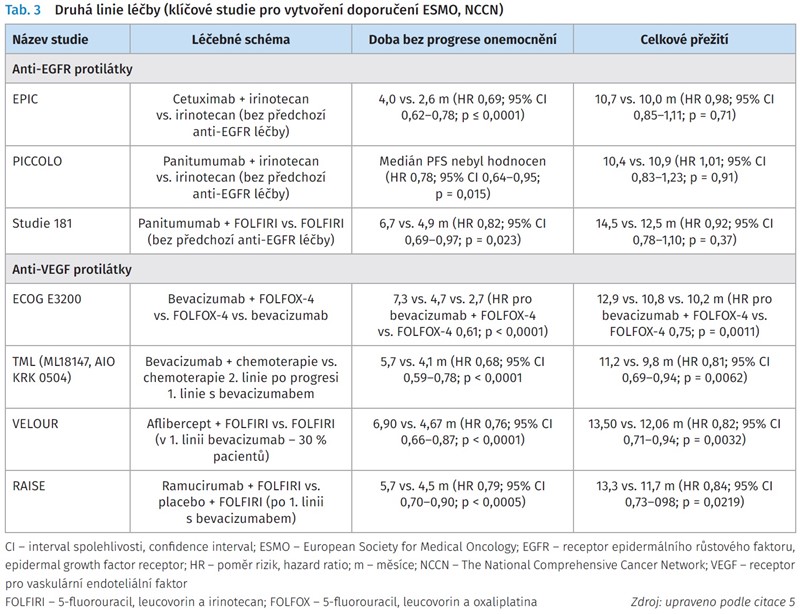
Algoritmus 2. linie léčby se odvíjí od použité léčby v 1. linii. Do léčebných možností lze zahrnout obě kombinace, a to fluorouracil, leucovorin a irinotecan (FOLFIRI) a fluorouracil, leucovorin a oxaliplatina (FOLFOX) v závislosti na předchozí systémové léčbě (tab. 3).7,15 Sekvence chemoterapie FOLFOX-FOLFIRI nebo naopak nemá žádný dopad na délku přežití.16 Vnesením biologické léčby se tato otázka významně komplikuje. Za zmínku stojí čtyři studie fáze III, ve kterých byla použita antiangiogenní léčba po předchozí léčbě inhibitorem VEGF bevacizumabem ve 2. linii léčby.17-19 Do této skupiny patří bevacizumab (studie ML18147), ramucirumab (studie RAISE) a aflibercept (studie VELOUR). Kromě bevacizumabu nebyly jiné anti-VEGF protilátky srovnávány, pouze oproti FOLFIRI.18'19 Bevacizumab byl podáván i v kombinaci s FOLFOX.17,20 Proč jsou multikinázové inhibitory (ramucirumab a aflibercept) účinné po podání bevacizumabu, dokazují výsledky studie RAISE. Retrospektivní analýza hodnoty VEGF-D byla užitečná pro rozhodnutí, zda pokračovat v léčbě bevacizumabem nebo v jiné anti-VEGF/VEGFR terapii. Vysoká hodnota VEGF-D po léčbě bevacizumabem koreluje s účinností ramucirumabu ve studii RAISE.21
Otázkou zůstává účinnost anti-EGFR protilátek, u kterých se nepodařilo prokázat prodloužení celkového přežití ve 2. linii.22-24 Tento problém vychází nejspíše z nesprávného nastavení sekvence léčby v 1. linii a 2. linii u pacientů s wtRAS. Správné použití inhibitoru VEGF bevacizumabu nebo inhibitorů EGFR cetuximabu a panitumumabu v 1. linii u této skupiny pacientů je zásadní pro účinnost léčby jak v 1. linii, tak v následných liniích léčby. Vzhledem k jejich odlišným mechanismům působení na nádorové buňky a mikroprostředí tumoru (cytostatické/cytotoxické versus antiangiogenní) a jejich přímé zaměření na cílové buňky (nádorové buňky versus stromální buňky nádoru) není překvapením, že biologické vlastnosti nádoru po 1. linii inhibitory EGFR a VEGF jsou zcela odlišné. Mohou tak přímo ovlivnit jejich citlivost při 2. linii léčby. To vyvolává potřebu pečlivě zkoumat vliv těchto látek na biologické změny v nádoru po jejich aplikaci. Stávající preklinické a klinické údaje poskytují možná zdůvodnění. Existují již biologické podklady pro volbu léčby u pacientů s wtRAS kolorektálním karcinomem. První linie léčby inhibitory EGFR může vyvolat jedinečné biologické změny v nádoru, které vedou ke zlepšení jejich vnímavosti na následující linii léčby, a naopak léčba inhibitory VEGF v 1. linii může vyvolat takové biologické změny v nádo - ru, které významně sníží citlivost nádoru k následné 2. linii.
HYPOXIE A JEJÍ VLIV NA AKTIVITU DIVOKÉHO A MUTOVANÉHO RAS
Gen RAS hraje důležitou úlohu v přenášení signálu z aktivovaného EGFR do buněčného jádra.
Hypoxie vzniká při překotném růstu nádoru a zvětšení vzdálenosti mezi cévami a tumorózními buňkami. Tento stav vede ke změnám uvnitř nádorové buněčné populace. Hypoxické podmínky mohou vyvinout selektivní tlak na nádorové buňky, a vytvořit tak populaci schopnou přežít v hypoxickém mikroprostředí. Tato schopnost je spojena se špatnou prognózou a odolností vůči terapii.
V hypoxickém mikroprostředí nádoru se buňky, které byly wtRAS, začnou chovat jako RAS mutované a jsou nezávislé na zevní stimulaci EGFR.
KRAS je malá GTPáza (GTP-fosfohydroláza), která je aktivována fosforylací z neaktivního guanosindifosfátu (GDP) na aktivní guanosintrifosfát (GTP).25 Slouží jako signální molekula, která se aktivuje prostřednictvím EGFR. Spouští efektorovou dráhu RAS-MEK-ERK a PI3K (fosfatidylinositol-3-kináza)-AKT kaskádu, která kontroluje buněčné odpovědi na stimulaci růstovými faktory. Onkogenní mutace genu KRAS zhoršuje schopnost hydrolýzy GTP vázaného KRAS, a tím jeho aktivita trvale stimuluje efektorové dráhy, které KRAS aktivují. Hypoxie významně ovlivňuje mikroprostředí nádoru, a může tak mít velký vliv na buněčné chování, které je řízeno mnoha onkogenními signálními dráhami. Dosud byly popsány hypoxické aktivace PI3K-AKT, MEK-ERK, NF-kB a vliv hypoxií indukovaného faktoru 1 (hypoxia-induced factor, HIF-1) na tyto signální dráhy.26,27 KRAS je centrální regulátor všech těchto drah a byla prokázána silná synergická interakce mezi hypoxií a mutovaným genem KRAS vyjádřená v regulaci mnoha cílových genů, včetně VEGF, IL-8 a osteopontinu.28,29,30 Chování wtRAS v hypoxickém mikroprostředí a jeho vliv na signální dráhy zkoumal Zeng et al.31 Prokázal, že v hypoxickém mikroprostředí nádorů tlustého střeva je divoký KRAS silně aktivován pomocí c-Src (proto-oncogen tyrosin-protein kinase Src) nebo HIF-1. Tato aktivita se projevuje vysokou fosforylací KRAS (GTP vázaný na KRAS), jak bylo prokázáno na buněčných liniích Caco-2, HT29, Colo320DM a Colo205. Tato aktivita je nezávislá na expresi a aktivitě EGFR. Aktivace KRAS vede k fosforylaci AKT a k indukci exprese VEGF. Navíc hypoxická aktivace wtKRAS (divoký typ [wild type] KRAS) vede k blokádě apoptózy. Dohromady tato zjištění zvýrazňují nový mechanismus pro hypoxickou aktivaci onkogenních drah sloužící k přežití nádorových buněk i za nepřítomnosti onkogenní mutace. Výsledky prokázaly, že hypoxie j e účinný aktivátor wtKRAS u nádorových buněk tlustého střeva, který se stává nezávislý na aktivitách EGFR.
O mechanismech vztahu a interakcemi mezi dráhami řízenými VEGF a EGFR na podkladě jejich farmakologické inhibice byly předloženy preklinické důkazy.
Intravenózní podání antiangiogenní protilátky (anti-VEGF) vyvolává nárůst hodnoty VEGF-A. Derangere et al.32 poprvé prokázali, že zvýšená hodnota cirkulující VEGF-A u pacientů léčených bevacizumabem indukuje rezistenci na cetuximab. Kontrolní skupina pacientů bez léčby s bevacizumabem se touto rezistencí nevyznačovala. Rezistence byla prokázána na třech buněčných liniích kolorektálního karcinomu (SW48, Caco-2 a Colo320). Mechanismus, který ji vyvolal, je spojen se zvýšenou aktivitou VEGFR-2, který je stimulován vysokou hodnotou VEGF-A. Ten prostřednictvím STAT3 a c-Src aktivuje KRAS a výsledkem je aktivovaná celá MAPK (mitogenem aktivovaná proteinkinázová dráha RAS-RAF-MEK a ERK1/2). RAS je nezávislý na zevní stimulaci EGFR. Terapeuticky indukovaná hypoxie může vést k biologickým a molekulárním změnám, které umožňují nádorovým buňkám přežít v metabolicky stresových podmínkách. Zároveň dochází ke zvýšení agresivity a invazivity růstu nádoru. Tyto změny nazýváme buněčný epiteliálně-mezenchymální přechod (epitelial mesenchymal transition, EMT). Vyznačuje se ztrátou epiteliálních markerů (např. snížená exprese E-cadherinu) a přeměnou buněk v mezenchymální fenotyp (zvýšená exprese vimentinu, CXCR4). Takové buňky jsou vybaveny schopnostmi intersticiální pohyblivosti a tvorbou metastáz.33
Léčba inhibitory EGFR vyvolává vznik rezistence, která se objevuje v průměru mezi 6.-10. měsícem léčby. Je způsobena inovačními mutacemi rodiny KRAS.34 Zhang et al. prokázali, že mutovaný KRAS je silný induktor VEGF exprese, která se může vyvíjet v průběhu léčby, kdy vzniká populace nádorových RAS mutovaných buněk.28 Buněčné linie karcinomu tlustého střeva s vysokou aktivitou mutovaných KRAS buněk vykazovaly zvýšenou aktivaci genu VEGF, kterou bylo možno zrušit inhibitory na RAS navazujících signálních drah PI3K a AKT. Na buněčných liniích různého původu včetně karcinomu tlustého střeva (karcinom prsu: MDA-MB-468, GEO a karcinom tlustého střeva PC3) bylo prokázáno, že v průběhu vzniku rezistence na anti-EGFR terapii (gefitinib, cetuximab) došlo k významnému nárůstu exprese VEGF, VEGFR-1 a placentárního růstového faktoru (placental growth factor, PIGF) receptorů, které velmi dobře odpovídaly na léčbu multikinázovými antiangiogenními inhibitory.35 Tyto poznatky byly potvrzeny na modelech s xenoimplantátem lidského spinocelulárního karcinomu na myších (buněčná linie A431).36 Buňky, které získaly rezistenci na anti-EGFR terapii, vykazovaly zvýšenou expresi receptorů VEGF a v celé nádorové tkáni se významně zvýšila hustota cév. Tyto poznatky jsou další součástí preklinického zdůvodnění teorie určitých zákonitostí při stanovení správné sekvenční léčby. Rozdíly ve strategii anti-EGFR a anti-VEGF terapie vycházejí z biologické odlišnosti cílů této léčby. Rezistence na anti-EGFR terapii je dán přítomností mutace RAS nebo se vyvine v průběhu léčby anti-EGFR u wtRAS a vede k senzibilizaci tumoru na antiangiogenní léčbu. Tyto poznatky by měly být brány v úvahy při stanovení terapeutického plánu.
Data z klinických studií léčby metastazujícího wtRAS kolorektálního karcinomu s inhibitory anti-EGFR + chemoterapií a inhibitory anti-VEGF + chemoterapií v 1. linii léčby naznačují správnost poznatků z preklinických studií. Ovlivnění biologického chování nádorových buněk jednotlivými protilátkami má vliv na výsledky následné léčby.
Studie FIRE-3, PEAK a CALGB/SWOG 80405 porovnaly léčbu inhibitory EGFR a standardní chemoterapii (FOLFOX nebo FOLFIRI) s léčbou inhibitory VEGF a standardní chemoterapií v 1. linii u pacientů s metastazujícím kolorektálním karcinomem.
Studie fáze III FIRE-3 srovnávala cetuximab + FOLFIRI oproti bevacizumabu + FOLFIRI v 1. linii léčby u pacientů s wtKRAS metastazujícím kolorektálním karcinomem.37 Doba přežití bez progrese (progression free survival, PFS) byla podobná u obou léčebných ramen (10,3 vs. 10,0 měsíce; p = 0,55). Rozdíl byl pozorován u celkového přežití (overall survival, OS). Doba OS se u ramene s anti-EGFR terapií (cetuximab) výrazně prodloužila proti rameni s anti-VEGF (bevacizumab) 28,7 vs. 25,0 měsíce, p = 0,017. Rozšířená analýza s vyšetřením NRAS + KRAS jen prohloubila rozdíl v celkovém přežití mezi oběma rameny (33,1 vs. 25,6 měsíce, p = 0,011) ve prospěch léčby anti-EGFR přípravky a bez zaznamenání významného rozdílu v PFS (10,4 vs. 10,2 měsíce; p = 0,54).38
Studie PEAK byla randomizovaná studie fáze II srovnávající panitumumab + FOLFOX6 s bevacizumabem + FOLFOX6 v 1. linii léčby u pacientů s wtKRAS metastazujícím kolorektálním karcinomem.39 PFS bylo podobné u obou léčebných ramen (10,9 vs. 10,1 měsíce, p = 0,35), nicméně OS byl významně prodloužen u pacientů užívajících panitumumab oproti bevacizumabu (34,2 vs. 24,3 měsíců; p = 0,009). Aktualizovaná rozšířená analýza přinesla zlepšené PFS (13,0 vs. 9,5 měsíce; p = 0,029) a zlepšené OS (41,3 vs. 28,9 měsíce, p = 0,058) u pacientů užívajících panitumumab + FOLFOX6 oproti pacientům léčených bevacizumabem + FOLFOX6.
CALGB/SWOG 80405 byla studie fáze III, která porovnala cetuximab + chemoterapii (podle výběru zkoušejícího FOLFOX nebo FOLFIRI) oproti bevacizumabu + chemoterapie (podle výběru zkoušejícího FOLFOX nebo FOLFIRI) u pacientů s metastazujícím wtKRAS kolorektálním karcinomem.40 Podle výsledků studie CALGB/SWOG 80405 byly OS a PFS srovnatelné nezávisle na typu biologické léčby (cetuximab + chemoterapie 29,9 měsíce versus bevacizumab + chemoterapie 29,0 měsíce, p = 0,34). Podobně PFS byl shodný při léčbě cetuximabem + chemoterapie a bevacizumabem + chemoterapie (10,4 vs. 10,8 měsíce; p = 0,55).
Rozdíly ve studiích vedly k rozsáhlým analýzám všech studií. Ukazuje se, že nemalý podíl na celkovém přežití má výběr již 1. linie. Rozdělení křivek OS u studií FIRE-3 a PEAK je patrné až po určité době. Vliv výběru správné sekvence 1. a 2. linie léčby na OS ve studii FIRE-3 byl prokázán v analýze 2. linie léčby, do které bylo zařazeno 414 pacientů (69,9 %), a 3. linii léčby, kterou absolvovalo 256 pacientů (43,2 %). Ve skupině s cetuximabem (rameno A) 47,1 % pacientů pokračovalo ve 2. linii s léčbou bevacizumabem a ve skupině s bevacizumabem (rameno B) 52,2 % pacientů bylo ve 2. linii léčeno cetuximabem nebo panitumumabem. Oxaliplatina byla následně podána u 55,9 % (rameno A) a u 53,2 % (rameno B) pacientů. Léčba ve 2. linii byla podávána v průměru po dobu 5,0 měsíce v rameni A oproti 3,2 měsíce v rameni B (p < 0,001). Doba přežití bez progrese byla 6,5 vs. 4,7 měsíce (poměr rizik [hazard ratio, HR] 0,68; 95% interval spolehlivosti [confidence interval, CI] 0,54-0,85; p < 0,001) a OS od začátku 2. linie bylo lepší v rameni A oproti rameni B (6,3) vs. 13,2 měsíce (HR 0,70; 95% CI 0,55-0,88; p = 0,0021). Tyto výsledky potvrzují biologický vliv anti-EGFR (cetuximabu a panitumumabu) a bevacizumabu na nádorové buňky a jejich senzibilizaci na následující léčbu.41 Rozdíly mezi studiemi FIRE-3, PEAK a CALGB/SWOG 80405 jsou dány celou řadou odlišností, jejichž vyjmenování není cílem tohoto přehledu. Vyhodnocení prospěšnosti anti-EGFR léčby v 1. linii potvrzují tři metaanalýzy. Khattak et al. zveřejnili v červnu 2015 metaanalýzu výsledků léčby 2 014 pacientů ze tří studií, která potvrdila prospěch podání terapie anti-EGFR v 1. linii u pacientů s metastazujícím wtRAS kolorektálním karcinomem.42 Četnost objektivní odpovědi (objective response rate, ORR) byla o 31 % vyšší (p = 0,01) a došlo ke zlepšení OS (HR 0,79; p = 0,03). Účinek byl vyšší u wtRAS. Nebyl pozorován žádný rozdíl v PFS. Další metaanalýza studií PEAK, FIRE-3, CALGB, COIN, PRIME, OPUS a CRYSTAL hodnotila účinek 1. linie léčby anti-EGFR přípravky + chemoterapie versus chemoterapie nebo chemoterapie + bevacizumab u 2 719 pacientů s metastazujícím wtRAS kolorektálním karcinomem.43 V dílčí analýze porovnávající léčbu anti-EGFR a anti-VEGF přípravky (1 171 pacientů) byl potvrzen příznivý účinek léčby anti-EGFR v 1. linii, což potvrdily výsledky celkového přežití (HR = 0,80; p = 0,003). Metaanalýza aktualizovaných údajů studií PEAK, FIRE-3 a CALGB u 1 096 pacientů s metastazujícím wtRAS kolorektálním karcinomem ukázala jasnou výhodu terapie anti-EGFR přípravky v 1. linii léčby se snížením rizika úmrtí o 24 % (HR 0,76; p = 0,018).44 Všechny výsledky studií nejsou přesvědčivé, ale vcelku potvrzují naše znalosti o biologické odpovědi nádorových buněk na léčbu anti-EGFR a anti-VEGF přípravky a prokazují důležitost správného sekvenování léčby pro dosažení optimálního klinického přínosu.
Závěry studií byly potvrzeny výsledky retrospektivní analýzy studie VELOUR, kdy byl ve 2. linii podán aflibercept po 1. linii terapie anti-VEGF přípravky. U pacientů léčených bevacizumabem byla zjištěna vysoká hodnota VEGF-A (průměr 753-763 pg/ml) oproti skupině bez léčby bevacizumabem (149-165 pg/ml).45 Byl potvrzen biologický dopad léčby bevacizumabem u buněk metastazujícího wtRAS kolorektálního karcinomu. Bevacizumab indukuje vysokou hodnotu VEGF-A, která způsobuje rezistenci vůči cetuximabu tím, že aktivuje dráhu VEGFR-2/Stat-3 a fosforylaci ERK1/2 vedoucí ke stimulaci nádorové proliferace nezávisle na účinku inhibice EGFR cetuximabem.46 Na druhé straně léčba anti-EGFR přípravky zvyšuje selektivně počet mutací RAS, které jsou spojeny se zvýšenou expresí VEGF, VEGFR-1 a PIGF47, což usnadňuje uplatnění afliberceptu48 a dalších multikinázových inhibitorů, jako je regorafenib.49
Ve 2. linii jsou u skupiny pacientů s mutací BRAF V600 zkoušeny přímé inhibitory této mutace encorafenib v kombinaci s inhibitorem MEK1/2 binimetinibem a cetuximabem, protilátkou anti-EGFR. Tato téměř kompletní blokáda mitogenem aktivované proteinkinázové signální dráhy (mitogen-activated protein kinases, MAPK) významně ovlivňuje nádorový růst.
Výsledky studie fáze III BEACON na 2. linii jsou velmi povzbudivé. Medián celkového přežití dosáhl 15,3 měsíce (95% CI 9,6-ND), medián při sledování zatím 18,2 měsíce. Medián doby bez progrese byl 8,0 měsíce (95% CI 5,6-9,3).
TŘETÍ LINIE LÉČBY
Výběr látek pro 3. linii léčby se řídí molekulárním profilováním nádoru samotného, celkovým stavem pacienta a toxicitou léčby, kterou máme ještě k dispozici.
Pro 3. linii zůstávají podle doporučení ESMO a NCCN protilátky anti-EGFR, multikinázový inhibitor anti-VEGFR a antimetabolit. U pacientů s wtRAS, kteří dříve nebyli léčeni terapií anti-EGFR přípravky, můžeme použít protilátky anti-EGFR cetuximab v kombinaci s irinotecanem a panitumumab. U pacientů, kteří byli předléčeni fluoropyrimidiny, oxaliplatinou, irinotecanem a bevacizumabem, jsou dalšími možnostmi multikinázový inhibitor anti-VEGFR regorafenib a antimetabolit trifluridin/tipiracil. Prodloužení přežití u posledních dvou jmenovaných látek, kterého bylo dosaženo ve 3. linii léčby ve studiích fáze III, se nejeví jako významný. Celkový přínos pro přežití u regorafenibu ve studii fáze III CORRECT proti placebu dosáhl 1,4 měsíce (medián 6,4 vs. 5,0 měsíce; HR 0,77; p = 0,0052).51 Podobný výsledek byl dosažen u trifluridin/tipiracilu ve studii RECOURSE - zlepšení přežití o 1,8 měsíce ve srovnání s placebem (medián 7,1 vs. 5,3 měsíce; HR 0,68; p < 0,001).52 Pokud jde o volbu sekvence použití regorafenibu versus trifluridin/tipiracil, mohou být léčiva použita v jakémkoliv pořadí, a to na základě preferencí pacientů a lékařů. Rozhodující je typ toxicity, který je u těchto látek odlišný. Určitým vodítkem může být použití léčebných přípravků v předchozí linii léčby. Zařazení regorafenibu můžeme preferovat po terapii anti-EGFR v 2. linii, kde lze přepokládat, že při vzniku rezistence na RAS dochází k expresi VEGF a VEGFR, které regorafenib může inhibovat. Po léčbě protilátkami anti-VEGF nebo anti-EGFR se jeví jako vhodnější použít antimetabolit.
Nesporným faktorem při výběru léčby ve 3. linii je druh toxicity. Její respektování je mnohdy zásadní v individuálním výběru léčby, pokud je kvalita života preferována před léčebným cílem, kterým je prodloužení života. Jednotlivé látky se liší druhem toxicity. Například inhibitory EGFR mohou vyvolávat kožní toxicitu spojenou s výskytem akneiformní vyrážky, změnu kožních adnex a průjem.53 Multikinázový inhibitor může způsobit kožní reakci typu ruka-noha, únavu, průjem a hypertenzi.54 Antimetabolity mohou vyvolat hematologickou toxicitu až útlum krvetvorby v kostní dřeni a gastrointestinální toxicitu.55
Novou možností léčby, která byla použita ve 3. linii, je imunoterapie. Její účinnost je závislá na imunogennosti nádoru, dané množstvím antigenů, které jsou prezentovány imunitnímu systému. Nádory s vysokým podílem mutací mají také vysokou nabídku antigenu a jsou vhodné pro imunoterapii. U kolorektálního karcinomu se jedná o malou skupinu onemocnění, která mají deficit DNA mismatch repair genů, jejichž úkolem je odstranit chybné párovaní bází DNA. Vyskytuje se u pacientů s Lynchovým syndromem, kde nacházíme vysokou nestabilitu mikrosatelitů (MSI-H). Studie fáze II s protilátkami anti-PD-1, pembrolizumabem nebo nivolumabem, ukázaly slibnou míru odpovědí, a co je důležité, s dlouhodobým účinkem.56-58 Výsledky nebyly dosud potvrzeny studiemi fáze III, ale přesto je tato léčba v doporučeních NCCN a pacientů s MSI-H.
Diskuse vyvolané analýzami velkých studií, jako byla FIRE-3, CALGB/SWOG 80405 a další, vedly k dalšímu genetickému vyšetřování kolorektálních nádorů. Výsledkem je exploze molekulárního profilování nádorů a jejím přínosem je identifikace nových cílů pro biologickou léčbu a imunoterapii. Jednou z nich je amplifikace HER2/neu (humánní epidermální receptor 2), která se jeví jako vhodný cíl pro léčbu s trastuzumabem, pertuzumabem59, laptinibem a trastuzumab emtasinem (TDM-1).60 Bohužel, tvoří jen okrajovou část pacientů (1,6-6,3 %).61
JAK POCHOPIT SEKVENOVÁNÍ TERAPIE A JEJÍ OPTIMALIZACI
Snaha docílit delšího celkového přežití u pacientů s nevyléčitelným metastazujícím kolorektálním karcinomem vedla k vytvoření určitého pohledu na stavbu sekvenční terapie. Zásadní je především volba 1. linie léčby. Filozofie tohoto rozhodnutí spočívá nejen na očekávaném prodloužení života, ale vychází i z biologického poznání nádoru a stanovení jednotlivých biologických podtypů nádorů. Při volbě cílené neboli biologické léčby hodnotíme také dopad na další linie léčby. Hodnotíme, jakým způsobem ovlivníme účinnost následné léčby v 2. linii. V následných liniích se většinou naše rozhodování zúží na prodloužení života za přij atelné toxicity pro pacienta. Ve většině studií, na kterých jsou založena léčebná doporučení pro sekvenční terapii u metastazujícího kolorektálního karcinomu, bylo chápání sekvenční terapie omezeno trváním léčby až do progrese bez možnosti přestávky léčby nebo její deeskalace.62,41
Zavedení oxaliplatiny do léčebných režimů a její kumulativní toxicita nás donutily uvažovat o přerušení, nebo alespoň deeskalaci léčby. V poslední době jsme svědky využití deeskalace a reeskalace v režimech s touto látkou, které umožňují významně prodloužit léčbu bez vzniku neřešitelné toxicity. Ukázalo se, že takto sekvenovaná léčba nevedla k poklesu její účinnosti. Na druhé straně musíme respektovat rozdíl progrese při plné léčbě a omezenou při deeskalované léčbě. Právě to, že odstraníme určitou látku z léčebného udržovacího schématu, nám umožní ji použít při následující reeskalaci. Postupně jsme poznali biologickou povahu nádoru a schopnosti cílené léčby ji v jejím průběhu měnit. Znalost genetických mutací nádoru nám pomáhá správně volit biologickou léčbu. Poznali jsme, jak se mění v průběhu jednotlivými liniemi terapie. Složení biologické léčby může ovlivnit výsledek terapie, která bude po ní následovat. Podrobná genetická analýza nádoru u jednotlivého pacienta usnadní volbu sekvenční léčby právě podle přítomnosti jednotlivých mutací. Jejich znalost povede k nastavení správné léčby šité na míru pro jednotlivého pacienta.
ZÁVĚR
Kombinované léčby s dublety a triplety 5-fluorouracilu, oxaliplatiny a irinotecanu jsou základními kameny současné sekvenční léčby. Vyšetření přítomnosti RAS a BRAF mutace je nezbytné pro stanovení 1. linie. Mělo by předcházet výběru kombinace chemoterapie a biologické léčby. Je zajímavé, že se ukazuje, že 2. linie není ovlivněna výsledkem vyšetření mutací. Ve 2. linii dominuje účinnost anti-VEGF protilátek bez ohledu na molekulární markery. Třetí linie se vyznačuje jen malým benefitem v prodloužení života oproti podpůrné léčbě. Přesto jsou skupiny pacientů, které z ní mají prospěch. Volbu 3. linie bychom měli vždy prodiskutovat s pacientem před jejím zahájením. Mělo by platit, že někdy málo znamená více. Přerušení nebo snížení intenzity léčby ještě před progresí onemocnění umožní použít vynechanou látku při reeskalaci léčby, a získat tak další prodloužení života pacienta. Neměli bychom zapomínat na nové možnosti ovlivnit růst nádorů s pozitivními molekulárními markery, jako je mutovaný BRAF a HER2 pozitivní nádor. Jedná se o malé skupiny pacientů s metastazujícím kolorektálním karcinomem, ale použití nových postupů, které známe z léčby melanomu nebo karcinomu prsu, přineslo pro tyto pacienty významný benefit. Metastazující kolorektální karcinom nepatří mezi imunogenní nádory a imunoterapie nepatří mezi zásadní léčebné postupy. Přesto u skupiny pacientů, kteří mají deficit DNA mismatch repair genů v nádoru, jsou výsledky dosažené imunoterapií velmi nadějné. Ukazuje se, že budoucnost léčby budeme určovat i podle složení mikrobiomu v trávicím traktu, protože různé populace bakterií pozitivně nebo negativně ovlivňují výsledek chemoterapie, radioterapie, biologické léčby a imunoterapie. Léčba metastazujícího kolorektální karcinomu tak pomalu spěje k preciznější léčbě šité na míru pacienta.
LITERATURA
- De Gramont A, Figer A, Seymour M, et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 2000;18:2938-2947.
- Goldberg RM, Sargent DJ, Morton RF, et al. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2004;22:23-30.
- Douillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 2000;355:1041-1047.
- Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014;371:1609-1618.
- Modest DP, Pant S, Sartore-Bianchi A. Treatment sequencing in metastatic colorectal cancer. Eur J Cancer 2019;109:70-83.
- Modest DP, Ricard I, Stintzing S, et al. Evaluation of survival across several treatment lines in metastatic colorectal cancer: analysis of the FIRE-3 trial (AIO KRK0306). Eur J Cancer 2017;84:262-269.
- Van Cutsem E, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016;27:1386-1422.
- Holch JW, Ricard I, Stintzing S, et al. The relevance of primary tumour location in patients with metastatic colorectal cancer: a meta-analysis of first-line clinical trials. Eur J Cancer 2017;70:87-98.
- Arnold D, Lueza B, Douillard JY, et al. Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol 2017;28:1713-1729.
- Seymour MT, Thompson LC, Wasan HS, et al. Chemotherapy options in elderly and frail patients with metastatic colorectal cancer (MRC FOCUS2): an open-label, randomised factorial trial. Lancet 2011;377:1749-1759.
- Cunningham D, Lang I, Marcuello E, et al. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol 2013;14:1077-1085.
- Hurwitz HI, Fehrenbacher L, Hainsworth JD, et al. Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J Clin Oncol 2005;23:3502-3508.
- Kabbinavar FF, Schulz J, McCleod M, et al. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase II trial. J Clin Oncol 2005;23:3697e705.
- Price TJ, Zannino D, Wilson K, et al. Bevacizumab is equally effective and no more toxic in elderly patients with advanced colorectal cancer: a subgroup analysis from the AGITG MAX trial: an international randomised controlled trial of Capecitabine, Bevacizumab and Mitomycin C. Ann Oncol 2012;23:1531-1536.
- Benson 3rd AN, Venook AP, Cederquist L, et al. Colon cancer, Version 1.2017, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw 2017;15:370-398.
- Tournigand C, Andre T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004;22:229-237.
- Bennouna J, Sastre J, Arnold D, et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol 2013;14:29-37.
- Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012;30:3499-3506.
- Tabernero J, Yoshino T, Cohn AL, et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine RAISE: a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015;16:499-508.
- Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007;25:1539-1544.
- Tabernero J, Hozak RR, Yoshino T, et al. Analysis of angiogenesis biomarkers for ramucirumab efficacy in patients with metastatic colorectal cancer from RAISE, a global, randomized, doubleblind, phase III study. Ann Oncol 2018;29:602-609.
- Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol 2008;26:2311-2319.
- Seymour MT, Brown SR, Middleton G, et al. Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fluorouracil-resistant advanced colorectal cancer (PICCOLO): a prospectively stratified randomised trial. Lancet Oncol 2013;14:749-759.
- Peeters M, Price TJ, Cervantes A, et al. Final results from a randomized phase 3 study of FOLFIRI {+/-} panitumumab for second-line treatment of metastatic colorectal cancer. Ann Oncol 2014;25:107-116.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993;366:643-654.
- Berra E, Pagès G, Pouyssègur J. MAP kinases and hypoxia in the control of VEGF expression. Cancer Metastasis Rev 2000;19:139-145.
- Blancher C, Moore JW, Robertson N, et al. Effects of RAS and Von Hippel Lindau (VHL) gene mutations on hypoxia-inducible factor (HIF)-1alpha, HIF-2alpha, and vascular endothelial growth factor expression and their regulation by the phosphatidylinositol 3'-kinase/Akt signaling pathway. Cancer Res 2001;61:7349-7355.
- Zhang X, Gaspard JP, Chung DC. Regulation of vascular endothelial growth factor by the Wnt and K-Ras pathways in colonic neoplasia. Cancer Res 2001;61:6050-6054.
- Xu L, Pathak PS, Fukumura D. Hypoxia-induced activation of p38 mitogen activated protein kinase and phosphatidylinositol 3'-kinase signaling pathways contributes to expression of interleukin 8 in human ovarian carcinoma cells. Clin Cancer Res 2004;10:701-707.
- Zhu Y, Denhardt DT, Cao H, et al. Hypoxia upregulates osteopontin expression in NIH-3T3 cells via a Ras-activated enhancer. Oncogene 2005;24:6555-6563.
- Zeng M, Kikuchi H, Pino MS, et al. Hypoxia activates the K-ras proto-oncogene to stimulate angiogenesis and inhibit apoptosis in colon cancer cells. PLoS One 2010;5:e10966.
- Derangere V, Fumet JD, Boidot R, et al. Does bevacizumab impact anti-EGFR therapy efficacy in metastatic colorectal cancer? Oncotarget 2016;7:9309-9321.
- Zhou J, Wang J, Zeng Y, et al. Implication of epithelial-mesenchymal transition in IGF1R-induced resistance to EGFR-TKIs in advanced non-small cell lung cancer. Oncotarget 2015;6:44332-44345.
- Siravegna G, Mussolin B, Buscarino M, et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients. Nat Med 2015;21:795-801.
- Bianco R, Rosa R, Damiano V, et al. Vascular endothelial growth factor receptor-1 contributes to resistance to anti-epidermal growth factor receptor drugs in human cancer cells. Clin Cancer Res 2008;14:5069-5080.
- Viloria-Petit A, Crombet T, Jothy S, et al. Acquired resistence to the antitumor effect of epidermal growth factor receptor blocking antibodies in vivo: a role for altered tumor angiogenesis. Cancer Res 2001;61:5090-6101.
- Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 2014;15:1065-1075.
- Stintzing S, Jung A, Rossius L, et al. Analysis of KRAS/NRAS and BRAF mutations in FIRE-3: A randomized phase III study of FOLFIRI plus cetuximab or bevacizumab as first-line treatment for wild-type (WT) KRAS (exon 2) metastatic colorectal cancer (mCRC) patients. Eur J Cancer 2013;49:abstract 17.
- Schwartzberg LS, Rivera F, Karthaus M, et al. PEAK: a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable, wild-type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol 2014;32:2240-2247.
- Venook AP, Niedzwiecki D, Lenz H-J. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). J Clin Oncol 2014;32(suppl):abstract LBA3.
- Modest DP, Stintzing S, von Weikersthal LF, et al. Impact of subsequent therapies on outcome of the FIRE-3/AIO KRK0306 Trial: first-line therapy with FOLFIRI plus cetuximab or bevacizumab in patients with KRAS wild-type tumors in metastatic colorectal cancer. J Clin Oncol 2015;33:3718-3726.
- Khattak MA, Martin H, Davidson A, et al. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. Clin Colorectal Cancer 2015;14:81-90.
- Pietrantonio F, Cremolini C, Petrelli F, et al. First-line anti-EGFR monoclonal antibodies in panRAS wild-type metastatic colorectal cancer: a systematic review and meta-analysis. Crit Rev Oncol Hematol 2015;96:156-166.
- Tamburini E, Rudnas B, Gianni L, et al. Anti-EGFR or Bevacizumab in first line treatment of RAS wild type metastatic colorectal neoplasm (RwtMCRC): meta-analysis of randomized clincal trials. Ann Oncol 2015;26(suppl 6):36-52.
- Van Cutsem E, Dochy E, Paccard C, et al. Impact of prior bevacizumab treatment on VEGF-A and PlGF levels and patient outcomes: a retrospective analysis of baseline plasma samples from the VELOUR trial. Ann Oncol 2017;28(suppl 3):137-149.
- Derangère V, Fumet JD, Boidot R, et al. Does bevacizumab impact anti-EGFR therapy efficacy in metastatic colorectal cancer? Oncotarget 2016;7:9309-9321.
- Bianco R, Rosa R, Damiano V, et al. Vascular endothelial growth factor receptor-1 contributes to resistance to anti-epidermal growth factor receptor drugs in human cancer cells. Clin Canc Res 2008;14:5069-5080.
- Holash J, Davis S, Papadopoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A 2002;99:11393-11398.
- Napolitano S, Martini G, Rinaldi B, et al. Primary and acquired resistence of colorectal cancer to anti-EGFR monoclonal antibody can be overcome by combined treatment of regorafenib with cetuximab. Clin Canc Res 2015;21:2975-2983.
- Van Cutsem E, Huijberts S, Grothey A, et al. Binimetinib, Encorafenib, and Cetuximab Triplet Therapy for Patients With BRAF V600E-Mutant Metastatic Colorectal Cancer: Safety Lead-In Results From the Phase III BEACON Colorectal Cancer Study. J Clin Oncol 2019. [Epub ahead of print]
- Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013;381:303-312.
- Mayer RJ, Van Cutsem E, Falcone A, et al. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015;372:1909-1919.
- Rogers JE. Patient considerations in metastatic colorectal cancer - role of panitumumab. Onco Targets Ther 2017;10:2033-2044.
- Krishnamoorthy SK, Relias V, Sebastian S, et al. Management of regorafenib-related toxicities: a review. Therap Adv Gastroenterol 2015;8:285-297.
- Uboha N, Hochster HS. TAS-102: a novel antimetabolite for the 21st century. Future Oncol 2016;12:153-163.
- Le Tourneau C, Delord JP, Goncalves A, et al. Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA): a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol 2015;16:1324-1334.
- Overman MJ, Lonardi S, Leone F, et al. Nivolumab in patients with DNA mismatch repair deficient-microsatellite instability-high metastatic colorectal cancer: update from CheckMate 142. J Clin Oncol 2017;35(suppl):abstract 519.
- Overman MJ, Lonardi S, Wong KYM, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair-deficient/microsatellite instability-high metastatic colorectal cancer. J Clin Oncol 2018;10;36:773-779.
- Siena S, Sartore-Bianchi A, Trusolino L, et al. Final results of the HERACLES trial in HER2-amplified colorectal cancer. Cancer Res 2017;77(suppl):abstract CT005.
- Siena S, Bardelli A, Sartore-Bianchi A, et al. HER2 amplification as a 'molecular bait’ for trastuzumab-emtansine (T-DM1) precision chemotherapy to overcome anti-HER2 resistance in HER2 positive metastatic colorectal cancer: the HERACLES-RESCUE trial. J Clin Oncol 2016;34(suppl):abstract TPS774.
- Sartore-Bianchi A, Marsoni S, Siena S. Human epidermal growth factor receptor 2 as a molecular biomarker for metastatic colorectal cancer. JAMA Oncol 2018;4:19-20.
- Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008;359:1757-1765.