Nutritional therapy in cancer patients
06/2017
MUDr. Viktor Maňásek
Komplexní onkologické centrum, Nemocnice Nový Jičín
SUMMARY
Tumor diseases are posed a significant risk of developing malnutrition. Nutritional therapy is an essential part of a comprehensive treatment strategy for malignancies. We have enough valid data supporting the meaningfulness of nutritional support to improve the clinical condition of patients and compliance with the treatment plan. The presence of active tumor causes the development of varied metabolic and humoral changes, interfering with the intake and processing of the individual nutrition components. This article summarizes the current view of nutritional intervention options in the conditions of the Czech Republic, including an overview of enteral and parenteral nutrition focusing on indication in various clinical situations.
KEY WORDS
malnutrition, anti-cancer therapy, cachexia, anorexia, enteral nutrition, parenteral nutrition
The full article is only available to subscribers
Become a regular subscriber to our Oncological Review...
DEFINICE NUTRIČNÍ PÉČE
Problematika stavu výživy u onkologicky nemocných je zásadním tématem, kterému je věnována velká pozornost odborníků různých specializací, ať už jde o lékaře rozličných odborností, zdravotní sestry, nutriční terapeuty apod. Tento zájem je logický, protože si uvědomujeme, jak významnou roli hraje stav výživy v průběhu nádorového onemocnění a prognóze nemocných.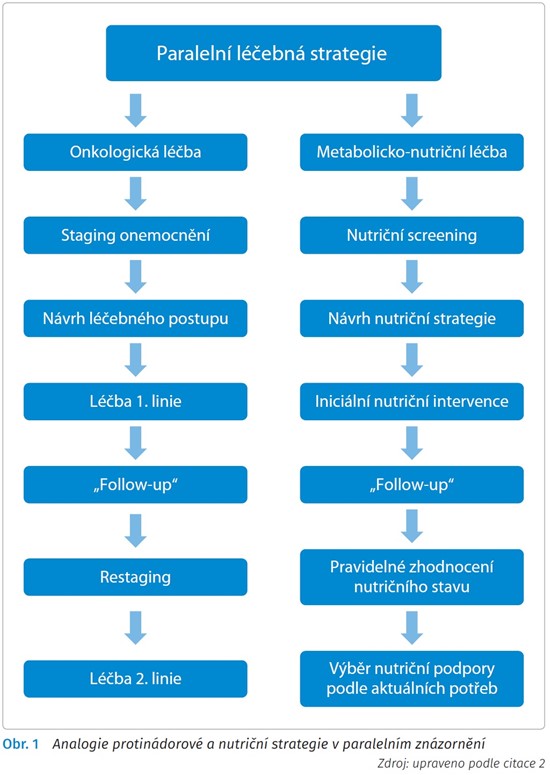
V názvu tohoto sdělení je rovněž záměrně zmíněno sousloví „nutriční léčba“ namísto obvykle užívaného „nutriční podpora“, protože výživu jako takovou vnímáme jako formu terapie. V odborných i laických publikacích se dočítáme, že nutriční intervence je nedílnou součástí protinádorové léčby, nicméně „podpora“ jako taková představuje široký pojem, který nedefinují ani vybraná kritéria pro posuzování výkonnosti a kvality onkologické péče v síti komplexních onkologických center v ČR. Tedy dokument vytvořený a autorizovaný členy Výboru České onkologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČOS ČLS JEP) na základě žádosti Ministerstva zdravotnictví ČR. V článku 3f tohoto dokumentu se konkrétně uvádí, že v onkologických centrech je „dostupnost specializované ambulantní nebo konziliární péče v oblastech léčba bolesti, nutrice, klinická psychologie, péče o stomie“.1
Je otázkou, jak si vyložíme náplň aktivit a povinnosti centra ve vztahu k nutriční péči. Stěžejní by pro nás měla být znalost toho, že nutriční intervence jako taková není podpora ve smyslu užívání vitaminových přípravků nebo podávání drahého jídla, nýbrž forma terapie, která zahrnuje systém komplexních nutričních opatření a postupů. Můžeme nalézt analogii k samotné protinádorové strategii, jak shrnuje obr. 1.2 V tomto ohledu jde s protinádorovou strategií ruku v ruce metabolicko-nutriční strategie, a to od diagnostiky až po ukončení léčby.
VÝSKYT MALNUTRICE
Prevalence malnutrice je u různých druhů malignit odlišná. Nejvýraznější výskyt podvýživy sledujeme u tzv. nutričně rizikových diagnóz, mezi něž řadíme například nádory hlavy a krku, jícnu, žaludku, plic a pankreatu. Americká společnost pro enterální a parenterální výživu (American Society for Parenteral and Enteral Nutrition, ASPEN) uvádí 60% výskyt malnutrice u nádorů horního oddílu gastrointestinálního traktu, u nádorů slinivky je to takřka 70 %.3 Bez ohledu na druh malignity je přes 40 % onkologických pacientů malnutričních. Podle některých zahraničních odhadů může malnutrice postihovat až 85 % nemocných, což má negativní vliv na výsledek léčby.4
Situace v České republice není odlišná. Ročně je v ČR nově diagnostikováno více než 78 500 zhoubných novotvarů a aktuálně žije v ČR více než 490 000 pacientů se zhoubnými nádory nebo s onkologickým onemocněním v minulosti.5 Epidemiologická zátěž v naší republice patří k nejvyšším na světě, mezi evropskými zeměmi se ČR řadí na osmou příčku v pořadí incidence zhoubných novotvarů.6 Incidence většiny maligních onemocnění se neustále zvyšuje, nicméně i přes tento nepříznivý trend se daří v posledních letech zastavit vzestup mortalitní křivky a v některých případech dokonce úmrtnost klesá (např. nádory prsu, kolorektální karcinom).5
První komplexní data popisující stav výživy onkologicky nemocných v ČR pocházejí z let 2011-2012, kdy byl v onkologických ambulancích proveden celonárodní nutriční průzkum, jehož se účastnilo přibližně deset tisíc pacientů.7,8 Podle výsledků tohoto průzkumu bylo 71,4 % ambulantních onkologických pacientů v ČR v riziku malnutrice, a to bez ohledu na fázi onemocnění, diagnózu nebo způsob léčby; 28,2 % pacientů mělo dokonce střední až extrémní riziko podvýživy. Každý čtvrtý pacient udával méně než polovinu obvyklého příjmu stravy. Prokázal se rovněž nedostatek specializované nutriční intervence, která byla poskytnuta pouze 12,5 % nemocných, přičemž většinou šlo pouze o poskytnutí obecných dietních rad nebo doporučení nákupu tekuté výživy (sippingu).
Protinádorová léčba malnutričního pacienta je zatížena zvýšeným rizikem selhání protinádorové léčby (a tím nižší pravděpodobností dosažení remise), pozorujeme zvýšený výskyt komplikací, pokles výkonnosti a zvýšenou mortalitu. Specifická protinádorová terapie představuje nemalou ekonomickou zátěž, a proto je prospěšné stanovit skutečnou ekonomickou efektivitu nutriční intervence. Kalkulace nákladů na nutriční péči je však obtížná, neboť komplikace způsobené podvýživou jsou maskovány za onemocnění, která nejsou dávána do souvislosti s malnutricí (zápal plic, ztráta pohyblivosti, srdeční selhání, opakované infekce, proleženiny, demence, nehojící se rány, embolie atd.).
S ohledem na evidentně negativní vliv malnutrice na průběh onemocnění, toleranci a celkový účinek léčby9-12 a výsledky stavu podvýživy v ČR začala Pracovní skupina nutriční péče v onkologii (PSNPO) při ČOS ČLS JEP usilovat o možnost preskripce sippingu onkologem za účelem včasné nutriční podpory před zahájením protinádorové léčby a v jejím průběhu. Na základě jednání s plátci zdravotní péče byla následně možnost preskripce schválena a aktuálně má onkolog za přesně stanovených podmínek možnost předepsat na recept přípravky pro sipping s úhradou zdravotní pojišťovny (pozn.: onkolog ve vztahu k preskripci = lékař specializace klinická onkologie, dětská onkologie a dětská hematologie, radiační onkologie a onkogynekologie). Jde o předpis na dobu maximálně čtyř týdnů v množství obsahujícím maximálně 600 kcal/den. Podmínkou je časová nebo místní nedostupnost nutriční ambulance a dokumentace nutričního rizika (2-4 body podle Dotazníku hodnocení nutričního rizika PSNPO). Preskripce se vztahuje na přípravky ATC skupiny V06XX (včetně proteinových či diabetických formulí, výživ obohacených o vlákninu apod.).13
ETIOLOGIE MALNUTRICE V ONKOLOGII
Proč je vlastně právě v onkologii podvýživa tak častá? Mnohdy jde o kombinaci několika etiologických faktorů, jejichž vlivem dojde k manifestaci podvýživy se všemi negativními důsledky. Nádorová malnutrice je kombinací obou známých krajních typů malnutrice, které představuje tzv. marasmus, tedy energetický deficit, a kwashiorkor, tedy proteinový typ malnutrice. U malignit jde o tzv. proteino-energetický typ malnutrice. Klinicky manifestní nádorová malnutrice je známa pod pojmem kachexie a není jen pozdním fenoménem, může být přítomna i v časných fázích malignity.14 Při ztrátě hmotnosti do 5 % hovoříme o prekachexii, která je doprovázena časnými metabolickými změnami s proinflamatorním laděním organismu (elevace prozánětlivých cytokinů, pokles albuminu). U vyjádřené kachexie dosahuje úbytek hmotnosti 10 %, je vyjádřen systémový zánět a často přítomna anorexie.15
Manifestace nádorové malnutrice kolísá od symptomů nechutenství s nízkým příjmem stravy až po převažující ztrátu hmotnosti i při zachovaném perorálním příjmu, a proto se v souvislosti s kombinací obou popsaných jevů můžeme v zahraniční literatuře setkat s pojmem syndrom nádorové anorexie-kachexie (cancer anorexia/cachexia syndrome, CACS). Setkáváme se rovněž s pojmy primární a sekundární malnutrice - podle toho, zda převažují humorální mechanismy, respektive zda je podvýživa způsobena poruchou příjmu stravy z důvodu nepříznivé lokality nádoru (nádory hlavy a krku, jícnu, žaludku atd.) nebo nežádoucích účinků protinádorové terapie (mukositida po radioterapii, emetogenní vliv cytostatik apod.).
METABOLICKÉ A HUMORÁLNÍ ZMĚNY U NÁDOROVÉ KACHEXIE
Pestré metabolické změny výrazně odlišují nádorovou malnutrici od prostého hladovění.16 Glukóza je sice nádorovou buňkou zvýšeně vychytávána, nicméně metabolizuje se pouze po laktát. Dochází navíc ke stimulaci glukoneogeneze (produkce glukózy z laktátu, glukogenních aminokyselin a glycerolu), prokazujeme glukózovou intoleranci a inzulinovou rezistenci. Nastává úbytek zásobního tuku, pozorujeme sníženou aktivitu lipoproteinové lipázy a zvýšení lipidémie. U hubnoucích pacientů s malignitou a přítomnou inzulinovou rezistencí je doporučeno zvýšit příjem energie z tuků na úkor sacharidů.17 Výrazné změny nastávají v metabolismu proteinů, protože dochází ke katabolismu bílkovin, navíc je blokována syntéza svalových proteinů na úkor syntézy bílkovin akutní fáze játry. Klidový energetický výdej je podle očekávání vyšší u tzv. nutričně rizikových malignit (viz výše).18
Uvedené metabolické změny jsou akcelerovány působením látek produkovaných jak nádorovou tkání, tak tkáněmi hostitele, a spolupodílí se na nich řada hormonálních změn (elevace kortizolu, adrenalinu atd.). Nádor zvýšeně produkuje proteolýzu indukující faktor (PIF), který aktivuje degradaci svalových bílkovin v proteasomu po navázaní ubiquitinu.19 Proteolýzu indukující faktor stimuluje aktivaci nukleárního faktoru kappa B, zvyšuje produkci cytokinů IL-6 a IL-8. Další substancí je faktor mobilizující lipidy, který vede k lipolýze.
Příčina nádorové anorexie není zcela objasněna. Předpokládá se porucha neurohumorální regulace chuti k jídlu v oblasti hypothalamu. Fyziologicky závisí centrální signály apetitu na souhře dvou typů neuronů, lokalizovaných v nucleus arcuatus hypothalami. Orexigenní signály (zvyšující apetit) vycházejí z neuronů produkujících neuropeptid Y (NPY neurony), anorexigenní signály (snižující apetit) pak z neuronů produkujících proopiomelanokortin (POMC neurony). Blokáda melanokortinových receptorů by tak mohla znamenat účinnou terapii anorexie.16
Dosud neexistuje léčivo, které by bylo schopno eliminovat nádorovou kachexii a anorexii, testuje se však celá řada látek ovlivňujících chuť k jídlu nebo zasahujících do nádorového metabolismu. Mezi orexigenní látky s krátkodobým účinkem patří kortikosteroidy, dlouhodobější příznivý účinek byl zaznamenán u gestagenních hormonů (megestrolacetát).20,21
Ke zvýšení apetitu u anorektických nemocných s pokročilou malignitou lze zvážit kortikoidy, ovšem jen na omezenou dobu (1-3 týdny) a s vědomím případných nežádoucích účinků, na které je třeba pamatovat!17 Iniciální dávka megestrolu je většinou 400 mg denně, při nedostatečném účinku ji lze zvýšit až na 800 mg za den, nicméně je nutno pamatovat na to, že účinek léčby se dostaví nejdříve za jeden až dva týdny a maximálního účinku se docílí po asi dvou měsících. Hlavními nežádoucími účinky mohou být otoky a zvýšené riziko trombembolické nemoci.
K blokádě proinflamatorního stavu byla testována nesteroidní antiflogistika (ibuprofen, indomethacin), anabolika a celá řada dalších látek, ať už samostatně, anebo v kombinacích.20,22'23 Aktuálně neexistují dostatečně silná klinická data pro doporučení kanabinoidů v léčbě anorexie, androgenů ke zvýšení svalové hmoty nebo nesteroidních antiflogistik ke zvýšení hmotnosti. V současnosti však probíhá řada randomizovaných studií, které by měly účinek některých léčiv potvrdit.17
Například názory na podávání w-3 mastných kyselin se dynamicky vyvíjejí a probíhající studie dosud přinášely rozdílnou míru klinických důkazů. Největší pozornost je věnována kyselině eikosapentaenové a kyselině dokosahexaenové. Kyselina eikosapentaenová je polynenasycená w-3 mastná kyselina s dlouhým řetězcem a je substrátem pro cyklooxygenázu a lipooxygenázu se vznikem eikosanoidů s protizánětlivým účinkem. Je kompetitivním antagonistou kyseliny arachidonové, která je konvertována na prozánětlivé eikosanoidy. V relativně zvýšeném množství jsou w-3 mastné kyseliny zastoupeny v rybím oleji a jsou dostupné rovněž v nutričních doplňcích. Minimální klinicky účinná dávka w-3 mastných kyselin je 2 g/den! Aktuálně je možno použít w-3 mastné kyseliny nebo rybí olej u pacientů s pokročilou malignitou v riziku malnutrice nebo v její přítomnosti, kteří podstupují chemoterapii, a to za účelem zvýšení chuti k jídlu, příjmu stravy a tělesné hmotnosti. Terapeutické užití w-3 mastných kyselin, argininu a nukleotidů shrnujeme pod termín imunonutrice.
Role imunonutrice není aktuálně jasně definována, doporučení Evropské společnosti pro enterální a parenterální výživu (European Society for Parenteral and Enteral Nutrition, ESPEN) nabádá k podání imunonutričních doplňků u pacientů s nádory horního trávicího traktu v perioperačním období.17
ÚSKALÍ ROZPOZNÁNÍ PODVÝŽIVY V ONKOLOGII
Zhodnocení stavu výživy je zásadní pro možnost stanovení nutričního rizika. Vzhledem k tomu, že metabolismus pacienta s maligním onemocněním se zásadně liší od metabolismu člověka s prostým hladověním (viz výše), je často odlišná i fyziognomie nemocných a malnutričního pacienta nemusíme na první pohled poznat. Ztrátu svalové hmoty s její dysfunkcí označujeme termínem sarkopenie2 V literatuře se objevuje rovněž pojem sarkopenická obezita.25
Tato data jsou podpořena i českým projektem, kdy byl zjišťován stav výživy ambulantně léčených onkologických pacientů. Průměrný body mass index (BMI) byl 26,8 kg/m2, tedy v pásmu nadváhy.7 To jen podporuje obecně známou skutečnost, že bez adekvátního nutričního screeningu nemusí být podvýživa patrná a nadváha, případně až obezita, maskuje malnutrici.
Sarkopenie je často příčinou zhoršení výkonnostního stavu pacienta, vyššího rizika nežádoucích účinků protinádorové léčby a zvýšené morbidity.25'26 Množství svalové hmoty jsme schopni kvantifikovat pomocí vyšetření výpočetní tomografií (computed tomography, CT), kdy je nejčastěji využíván řez v úrovni třetího bederního obratle a pomocí speciálního softwaru kalkulujeme celkovou plochu svalstva.27 Je nutné si uvědomit, že mezi pacienty se stejným BMI existuje výrazná variabilita v množství svalové hmoty. Vyšetření CT mohou jasně potvrdit, že například pacienti s BMI v rozmezí 16-40 kg/m2 mohou mít stejnou svalovou hmotu! Sval je navíc mnohdy patologicky infiltrován tukem, čímž je narušen metabolismus a výkonnostní kapacita svalové hmoty.28
Když si uvědomíme, že dávka většiny cytostatik je kalkulována podle tělesného povrchu, možná najdeme odpověď na to, proč se zásadně liší toxicita některých cytostatických režimů.10-12 Deplece proteinů zapříčiňuje oslabení svalstva (včetně dechového s následným rozvojem bronchopneumonie), poruchy iontového hospodářství poruchu transportu substancí závislých na bílkovinách, rozvíjí se acidóza a imunosuprese.
Sarkopenie je spojena s horšími výsledky protinádorové terapie, adekvátní nutriční podpora naopak rizika komplikací snižuje.26,29'30 Směrodatná tedy není jen samotná vyhublost, definovaná nízkým BMI, ale především údaj o dynamice v čase, tedy hubnutí za danou časovou jednotku (optimálně za poslední tři měsíce), a posouzení příjmu stravy (kvantitativně i kvalitativně). Tedy nejen toho, kolik toho pacient sní, ale rovněž toho, co sní.
Už v roce 1980 se panel expertů Eastern Cooperative Oncology Group (ECOG) zabýval otázkou, jaký je prognostický účinek úbytku hmotnosti před zahájením chemoterapie u nemocných s různými typy malignit.31 Například ve skupině pacientů s nádory tlustého střeva byl rozdíl celkového přežití mezi pacienty, kteří nehubli, ve srovnání s těmi, kteří zhubli do 5 % z původní hmotnosti, takřka dvojnásobný v neprospěch nemocných s úbytkem hmotnosti (46 vs. 26 týdnů). U nemocných s nádory žaludku byl rozdíl v celkovém přežití mezi těmi, u nichž byl popsán významný pokles hmotnosti, a pacienty bez úbytku hmotnosti více než tři měsíce. Zajímavým momentem uvedené studie je navíc to, že celkové přežití pacientů ve skupině s úbytkem hmotnosti nad 10 % nebylo kratší než u skupiny s úbytkem hmotnosti 5-10 %, ba dokonce tito pacienti přežívali déle. Další úbytkem hmotnosti už tedy prognózu nezhoršoval, zásadní byl rozdíl právě při úbytku hmotnosti do 5 %.
Tato data jen podporují fakt, že již malá ztráta hmotnosti má závažné důsledky. Tato skutečnost může být navíc snadno přehlédnuta, uvědomíme-li si, že 5% úbytek hmotnosti je přítomen například již u pacienta, který zhubl z původních 80 kg na 76 kg.
V průběhu protinádorové léčby se může sarkopenie ještě dále prohlubovat, jak dokládá studie u nemocných s nádorem jícnu, kde se po třech cyklech neoadjuvantní chemoterapie podíl pacientů se sarkopenií zvýšil o takřka 20 %.32 Jedna z recentně provedených analýz prokázala, že udržení svalové hmoty u nemocných s metastazujícím kolorektálním karcinomem by mohlo být i terapeutickým cílem. Bylo v ní totiž prokázáno, že ztráta svalstva během paliativní systémové léčby zkracuje celkové přežití, a sarkopenie v době první progrese byla spojena s kratší periodou do progrese další.33
SCREENING
Zhodnocení stavu výživy je zásadní z hlediska stanovení nutričního rizika. K dispozici je celá řada dostupných screeningových nástrojů, v onkologii má nejširší použití pravděpodobně Nutriční rizikový screening (Nutritional risk screening, NRS, 2002).34
Každé zdravotnické zařízení pečující o onkologicky nemocné má svůj nutriční screeningový nástroj při přijetí k hospitalizaci. Česká onkologická společnost ČLS JEP doporučuje screening pomocí NRS. Podmínkou účinnosti screeningu je reakce na výsledek šetření a provedení žádoucích opatření ze strany členů nutričního týmu, který však nemusí být na všech pracovištích jasně definován. Odlišná je situace v ambulantním provozu, kde byla s ohledem na vytíženost ambulancí pečujících o onkologicky nemocné snaha vytvořit jednoduchý screeningový dotazník, který zdravotnický personál příliš nezatíží a zároveň rychle a jasně rozdělí pacienty na pacienty nerizikové, pacienty v nutričním riziku a nemocné v jistém stupni podvýživy. Mezioborový tým odborníků Pracovní skupiny nutriční péče v onkologii vytvořil dotazník, který byl následně jako orientační screeningový nástroj schválen ČOS a jeho vyplnění je jednou z podmínek preskripce sippingu onkologem.35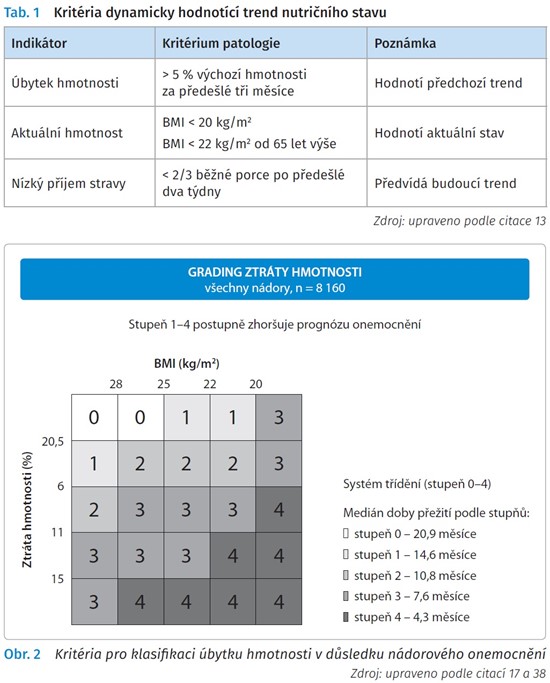
Včasné rozpoznání nutričního rizika je v každodenní klinické praxi důležitější než diagnostika manifestní podvýživy. Jako indikátory se používají základní anamnestické a antropometrické údaje (tab. 1).36 V rámci screeningu je doporučeno pravidelně vyhodnocovat příjem stravy, změny hmotnosti a BMI. Při abnormálním výsledku screeningu je vhodné objektivizovat deficit příjmu stravy kvantitativně, zhodnotit výkonnostní stav nemocného zároveň s posouzením svalové hmoty a úrovně systémového zánětu.17 Nápomocná jsou pak kritéria, která hodnotí dynamicky trend nutričního stavu s ohledem na úbytkem hmotnosti. Aktuální hmotnost a příjem stravy zachycuje tab. 1.
V posledních doporučeních ESPEN37 i ČOS ČLS JEP36 se nově objevují diagnostická kritéria ztráty tělesné hmotnosti - tzv. nutriční grading, který koreluje s očekávanou délkou přežití (obr. 2). Data vycházejí z recentní studie u více než 11 000 onkologicky nemocných, u kterých byly úbytek hmotnosti a úroveň BMI korelovány s průměrnou délkou přežití. Celkem 90 % těchto pacientů mělo maligní onemocnění v klinickém stadiu III nebo IV, dominantně byli analýze podrobeni nemocní s nádory plic, jícnu a gastrointestinálního traktu a také s nádory hlavy a krku. Na základě procentuálně stanoveného úbytku hmotnosti a BMI byli nemocní stratifikováni do pěti prognostických skupin podle celkové délky přežití. Medián celkového přežití ve skupině nutričního stupně 0 byl napříč všemi malignitami přibližně 20,9 měsíce, zatímco ve skupině nutričního stupně 4 pouze asi 4,3 měsíce. Stupeň 4 představoval příliš krátké přežívání ve vztahu k protinádorové léčbě a korespondoval i s kritérii toxicity stupně 4 podle Common Terminology Criteria for Adverse Events (CTC-AE). Grading by mohl být přínosem pro stratifikaci nemocných v klinických studiích.38
MOŽNOSTI NUTRIČNÍ INTERVENCE
Stěžejním doporučením je poskytnutí obecných dietních rad. Již v době diagnostiky nádorového onemocnění je vhodné pacienta a jeho blízké informovat o významném vlivu výživy na průběh léčby. Existuje celá řada informačních zdrojů na internetu, kde je dostupný návod na vhodný typ stravování včetně doporučených potravin.35 Správně vedená nutriční edukace může mít zásadní význam pro zlepšení stavu výživy, a především compliance pacienta. Ideálně se to daří v případě, kdy je poskytnuta odborná pomoc nutričním terapeutem.
Nutričnímu poradenství včetně edukace o významném efektu fyzické aktivity je přikládán velký význam i v posledních doporučeních ESPEN z roku 2016.17 Nutriční terapeut rovněž stanoví potřebu živin. Aktuálně je doporučen energetický příjem 25-30 kcal/kg/den a dodávka bílkovin minimálně 1 g/kg/den, je-li to možné, tak až 1,5 g/kg/den. Některá data podporují i vyšší dávky proteinů - až 2 g/kg/den.17
Každý onkologický pacient v nutričním riziku by měl být vyšetřen nutričním terapeutem s návrhem konkrétní terapie. Optimální je objednat takového pacienta rovnou do nutriční ambulance, kde mu bude poskytnuta specializovaná péče lékařem-nutricionistou, a to včetně doporučení přípravků enterální výživy, případně i výživy parenterální (viz dále). Seznam nutričních ambulancí je dostupný na webových stránkách Společnosti klinické výživy a intenzivní metabolické péče (SKVIMP).39 V případě časové a/anebo místní nedostupnosti má onkolog možnost předepsat pacientovi přípravky tekuté enterální výživy, tzv. sippingu (podmínky preskripce viz výše).
Aby byla případná nutriční intervence úspěšná, je nutné před zahájením protinádorové léčby (a v jejím průběhu) vyloučit specifické situace, které mohou interferovat s příjmem stravy. K tomu nám pomohou tyto otázky: Ovlivňuje lokalita nádoru příjem stravy nebo pasáž gastrointestinálním traktem? Má dané onemocnění potenciál ovlivňovat negativně metabolismus? Jsou přítomny symptomy interferující negativně s příjmem stravy? Je přítomno iatrogenní hladovění během diagnostiky a následné terapie?Je dobře vedena profylaxe nevolnosti a zvracení? Je dobře léčena mukositida?
Jestliže lokalita nádoru ovlivňuje příjem stravy, je obecně řešením provedení perkutánní endoskopické gastrostomie profylakticky (např. u nádorů hlavy a krku)40, provedení spojkové operace k překlenutí obstrukce (nádory gastrointestinálního traktu, pankreatu atd.) nebo časné založení protektivní stomie před zahájením radiochemoterapie (např. u kolorektálních nádorů). V případě nádorů jícnu a žaludku je provedení perkutánní endoskopické gastrostomie problematické, ať už z důvodu rizik při manipulaci v blízkosti nádorové infiltrace, anebo kontraindikace k provedení gastrostomie před plánovanou tubulizací žaludku v případě radikální ezofagektomie. Možností je založení jejunostomie, v případě nádorů střední a dolní třetiny jícnu a nádorů gastroezofageální junkce pak rovněž zavedení stentu. Dočasně lze obstrukci překlenout zavedením sondy (nazogastrické nebo nazojejunální), dlouhodobá přítomnost sondy je však pro pacienta zatěžující.
Má-li zhoubné onemocnění potenciál ovlivňovat výrazně negativně metabolismus hostitele (primární malnutrice), nemusí být pouhá suplementace výživovými doplňky dostatečná a řešením může být snaha o zvrat syndromu kachexie/anorexie farmakologicky.41 Apetit stimulují i některá antidepresiva (mirtazapin).
Pro dosažení adekvátního příjmu stravy je nutné léčit rovněž symptomy interferující negativně s jejím příjmem. Bolest, žízeň, dušnost a úzkost jsou silné symptomy, které svou intenzitou působení na pacienta staví pud sebezáchovy (udržením dobrého nutričního stavu) do pozadí. Řešením je adekvátní analgetická terapie, dostatečná hydratace, komplexní terapie dušnosti a samozřejmě psychologická intervence včetně farmakoterapie anxiety.
Samostatným tématem je iatrogenní hladovění během diagnostiky a následné terapie. Je nutné si zodpovědět otázku, zda je před laboratorními odběry nebo zobrazovacími vyšetřeními vždy nutné lačnění. Většina laboratorních krevních testů lačnění pacienta nevyžaduje, samozřejmě až na některé výjimky (koncentrace triglyceridů, glykémie, sedimentace apod.). Před „onkologickým“ laboratorním odběrem nemusí být pacient nezbytně nalačno. V některých situacích je krátkodobé lačnění samozřejmě nutné, je však třeba mít na mysli, že energetický příjem lze „dohnat“ během dne a že je možné využít rovněž parenterální alimentaci.
Významnou kapitolou podpůrné léčby v onkologii je antiemetická profylaxe. Prevence je nezbytná jak při radioterapii, tak v průběhu chemoterapie. Pacient může mít správně vedenou profylaxi nevolnosti a zvracení, ale bez navazující nutriční podpory nemusí být výsledný efekt uspokojivý. Stejně tak pacient, který má odborně vedenou suplementaci výživy, nebude prospívat v případě, že entiemetická prevence bude nedostatečná. Nauzea a následné zvracení může zapříčinit nedodržení dávkové intenzity onkologické léčby, popřípadě i odmítnutí pokračování terapie ze strany pacienta. Musíme pamatovat také na mukositidu, ezofagitida se nemusí projevit jen odynodysfagií, mnohdy pacient popisuje jen příznaky nevolnosti a časné plnosti. Rovněž průjmům může být přisuzována jiná příčina než enteritida jako nežádoucí účinek radioterapie nebo chemoterapie.
Data pro doporučení glutaminu ke snížení postradiačních toxicit (stomatitida, ezofagitida, enteritida, dermatitida) nejsou dosud dostatečná.17 Pokročilá mukositida je rovněž jednou z indikací pro dočasnou opioidní analgetizaci.42 Riziko mukositidy v průběhu protinádorové terapie je jednou z indikací pro zavedení nazogastrické sondy nebo založení perkutánní endoskopické gastrostomie.17
Ve skupině cytostatických režimů vysokého a středního emetogenního rizika je adekvátní antiemetická profylaxe logicky vyžadována nejvíce, a kombinujeme tedy přípravky několika lékových skupin. Především jde o setrony (antagonisté 5-HT-3 receptorů), kortikosteroidy a antagonisty neurokininových (NK-1) receptorů. Podle potřeby lze případně kombinovat další přípravky - antagonisty dopaminergních (D2) receptorů, prokinetika, antipsychotika, anticholinergika, H1 antihistaminika a benzodiazepiny.43 S nástupem nových přípravků v posledních deseti letech významně poklesl podíl pacientů, kteří jsou nuceni zažít negativní zkušenost charakteru nevolnosti a zvracení.
U pacienta v průběhu radioterapie nebo chemoterapie je nutné vždy provést rovněž diferenciální diagnostiku nevolnosti a/nebo zvracení, neboť existuje celá řada jiných příčin zvracení, jejichž opomenutí může mít za následek chybné určení příčiny potíží a nesprávně zvolenou léčbu. Především je nutné vyloučit maligní hyperkalcémii, urémii, dekompenzaci diabetu a interkurentní infekci. Je nutná úvaha o riziku generalizace do centrálního nervového systému s rozvojem intrakraniální hypertenze.
DŮKAZY EFEKTU DIETNÍHO PORADENSTVÍ A SIPPINGU V PODMÍNKÁCH ČESKÉ REPUBLIKY
V českých podmínkách byly provedeny dva projekty prokazující příznivý efekt sippingu v onkologii - „Význam individualizované nutriční péče v onkologické ambulanci“ a „Efekt časné enterální výživy s vysokým obsahem bílkovin na komplikace a náklady léčby pacientů s kolorektálním karcinomem“.44
Cílem prvního projektu bylo porovnat vývoj nutričního stavu pacientů během probíhající protinádorové léčby, a to při poskytování běžné nutriční péče ve velké nemocnici a u pacientů s individualizovanou péčí nutričního terapeuta. Do intervenční skupiny byli zahrnuti nově diagnostikovaní nemocní s histologicky ověřeným karcinomem indikovaní k ambulantní léčbě při splnění vstupního nutričního kritéria (nutriční riziko podle dotazníku PSNPO 2-4 body). Pacientům byla poskytnuta individualizovaná dietní rada a byli instruováni k užívání sippingu k dosažení cílové hodnoty příjmu bílkovin 1 g/kg/den a energetické potřeby 30 kcal/kg/den. Ve dvoutýdenních intervalech byly hodnoceny vybrané parametry ve vztahu k nutričnímu stavu. Ve 12. týdnu od screeningu nebyl v intervenční skupině pacientů zaznamenán hmotností úbytek, kdežto v kontrolní skupině byl zjištěn pokles hmotnosti průměrně o 4,8 kg. Obdobně v testu svalové síly nebyl prokázán v intervenční skupině deficit, přičemž v kontrolní skupině došlo k poklesu svalové síly. Důležitým faktem je to, že efekt nutriční podpory se prokázal až ve 12. týdnu, což naznačuje nezbytnost vyhodnocení nutriční intervence s časovým odstupem. Individuálně podávaný sipping v průběhu onkologické léčby zabránil poklesu hmotnosti i svalové síly (a to i v dlouhodobém horizontu) a u intervenované skupiny bylo možné prokázat nižší výskyt infekčních komplikací (8 % vs. 24 %). Výrazného zlepšení nutričního stavu bylo dosaženo i přes relativně menší doporučenou dávku bílkovin, lze tudíž předpokládat velký význam dietních rad a individualizované nutriční intervence.
Cílem druhého projektu bylo zhodnotit efekt časné enterální výživy s vysokým obsahem bílkovin na výskyt komplikací a náklady na léčbu u pacientů s kolorektálním karcinomem, a to bez ohledu na nutriční stav. Pacienti byli instruováni o užívání proteinového sippingu v dávce 40 g bílkovin denně navíc k běžné stravě, a to minimálně deset dní před onkochirurgickým výkonem a dva týdny po operaci. Ve sledované skupině bylo zaznamenáno snížení komplikací - dehiscence rány byla 2,2krát nižší, dehiscence anastomózy 4,3krát nižší. Výskyt infekčních komplikací byl redukován na polovinu a nutnost rehospitalizace byla 1,7krát nižší. Byly kalkulovány úhrnné náklady, a to jak během hospitalizace, tak do šesti měsíců po propuštění. Je možno konstatovat, že došlo k významné redukci nákladů na provedené procedury, spotřebu materiálu a podaná léčiva, a to jak během hospitalizace, tak i v dalším průběhu sledovaného půlročního období. To opět podporuje tvrzení, že nejen klinický benefit nutriční intervence je nutno hodnotit s časovým odstupem, ale že i ekonomický přínos je prokazatelný při delším sledování.30
ENTERÁLNÍ VÝŽIVA V ONKOLOGII
Mezi přípravky enterální výživy řadíme jak přípravky určené k popíjení - sippingu (v zahraniční literatuře se setkáme i s označením oral nutritional support - ONS), tak přípravky sondové enterální výživy. Ty jsou podávány nazogastrickou nebo nazojejunální sondou, případně do umělých vyústění trávicího traktu (výživná gastrostomie, jejunostomie). Zásady správného používání sippingu jsou k dispozici na stránkách ČOS ČLS JEP.35
Nejrozšířenějším typem sondové enterální výživy jsou polymerní přípravky. K dispozici je několik druhů těchto přípravků s různým zastoupením energie a jednotlivých složek výživy. Koncentrované roztoky jsou značeny „energy“ a obsahují 1,5krát vyšší obsah živin ve stejném objemu jako přípravky standardní. K dispozici jsou rovněž vaky s vlákninou („fibre“) nebo vaky vysokoproteinové.
PARENTERÁLNÍ VÝŽIVA V ONKOLOGII
Parenterální výživa představuje podávání výživy mimo trávicí trakt, tedy přímo do žilního řečiště. Jelikož se nejedná o fyziologický způsob dodávky živin, je nitrožilní cesta aplikace spojena s vyšším rizikem případných komplikací. Parenterální výživa v onkologii je indikována buď jako totální, kdy je dodávka živin zajištěna výhradně nitrožilně, nebo jako doplňková, která je vhodná v případě nutnosti zvýšené dodávky makro-/mikronutrientů za situace, kdy enterální příjem není schopen pokrýt potřeby organismu. Enterální a parenterální výživa nejsou v tomto ohledu „konkurenti“, ale „spolupracovníci“, nicméně není-li enterální výživa kontraindikována, preferujeme vždy enterální přístup.
Obecně indikujeme parenterální výživu v případě nedostatečného perorálního či enterálního příjmu (méně než 60 % energetické potřeby déle než deset dní) v perioperačním období u malnutričních pacientů, kde není možná enterální výživa, a v paliativně-symptomatické péči v případě nedostatečného enterálního příjmu, a to při respektování těchto podmínek:
- předpokládané přežití je déle než 2-3 měsíce,
- cílem podávání parenterální výživy je stabilizace nebo zlepšení výkonnosti a kvality života pacienta,
- pacient je poučen a souhlasí s aplikací parenterální výživy.
Byla rovněž definována koncepce tzv. kritických nutričních bodů v průběhu onkologické léčby, kdy je nutné se maximálně zaměřit na nutriční podporu.45 Jde především o perioperační období a stavy s obecně nedostatečným enterálním příjmem, včetně mukositidy během protinádorové léčby (např. při konkomitantní radiochemoterapii). Koncepce doplňkové parenterální výživy opouští klasickou sekvenci postupného přechodu od perorálního příjmu k enterální výživě a až v poslední řadě k parenterální alimentaci. Tento postup můžeme využít například při omezeném využití gastrointestinálního traktu.
Parenterální výživa je aplikována systémem all-in-one, kdy jsou v jednom vaku smíchány všechny složky makronutrientů (cukry, tuky, aminokyseliny) a mikronutrientů (vitaminy, stopové prvky, elektrolyty). Parenterální výživu můžeme podávat buď cyklicky (10-18 hodin denně s respektováním noční pauzy), nebo kontinuálně (24 hodin). Pro potřeby domácí parenterální výživa je vhodný způsob podání přes noc, aby pacient nebyl limitován přes den ve svých běžných aktivitách.
Vaky je nutné chránit před světlem. Při jejich přípravě se doporučuje smísit nejprve aminokyseliny a glukózu a jako poslední smísit komoru s tukem (s cílem omezení snížení pH smísením glukózy s roztokem aminokyselin, jehož pufrovací kapacita tento efekt redukuje). Elektrolyty nemají být nikdy přidávány přímo do lipidové emulze, protože ji destabilizují. Přidávají se k roztoku aminokyselin a glukózy před smísením s lipidy. Po smísení tříkomorového vaku je nutné jej použít nejpozději do 24 hodin.
Stanovení dávky složek výživy
Komerční vaky pro parenterální výživu obsahují optimální zastoupení makronutrientů a minerálů, vitaminy a stopové prvky je nutné z důvodu stability přidat až před aplikací.
Dávky jednotlivých složek parenterální výživy jsou následující:
- Energie - v praxi se nejčastěji stanovuje výpočtem, a to vynásobením základního energetického příjmu (výpočet podle Harrisovy-Benediktovy rovnice) faktory tělesné teploty, míry stresu a aktivity. Průměrný energetický výdej bývá 25-30 kcal/kg/den. Centrální all-in-one vaky parenterální výživy obsahují asi 1 kcal/1 ml, periferní asi o třetinu méně.46
- Sacharidy - doporučená denní dávka glukózy je 3-6 g/kg. Množství sacharidů tlumících ketogenezi a katabolismus bílkovin je přibližně 150 g/den.
- Aminokyseliny - potřeba aminokyselin je 1-2 g/kg/den. Aby mohly být aminokyseliny adekvátně využity pro proteosyntézu, je nutné současné doplnění energie ze sacharidů.47
- Tuky - doporučená denní dávka je 1-1,5 g/kg. Podávají se formou tukových emulzí v 10% a 20% roztocích. Jsou izoosmolární, a proto snižují výslednou osmolaritu kompletního vaku.
- Mikronutrienty - parenterální výživa obsahuje také elektrolyty (Na, K, Cl, Ca, P, Mg), vitaminy a stopové prvky.
Overfeeding syndrom
Overfeeding syndrom (přetížení složkami výživy) může nastat při zahájení razantní nutriční intervence, především právě v případě parenterální výživy u malnutričních pacientů v katabolismu. Podobný stav může nastat rovněž u překročení doporučených dávek živin. Důsledkem je nadprodukce oxidu uhličitého s hyperkapnií, zvýšená lipogeneze, hyperglykémie a iontový rozvrat. Při převodu pacienta do anabolické fáze je zvýšená potřeba dodávky kalia, magnezia a fosforu. Nerozpoznaná hypofosfátémie se projevuje paresteziemi, svalovou slabostí, poruchami chování, anorexií a hrozí i rozvoj kómatu. Často bývá vyšší potřeba vitaminů, hlavně B1, B2, B , C a K, ze stopových prvků se setkáváme s deficiencí zinku. Při rozvoji acidózy bez jiných zjevných příčin je nutno pamatovat na riziko laktátové acidózy z deficience thiaminu.
V úvodu se proto doporučuje dávky parenterální výživy redukovat o 25-50 % a poté postupně navyšovat za kontroly klinického stavu, tělesných funkcí, bilance tekutin a laboratorních kontrol (mineralogram, urea, kreatinin, glykémie, jaterní testy, prealbumin, lipidogram, krevní obraz). Důrazně dbáme na hrazení mikronutrientů.17
Žilní vstupy pro parenterální výživu
Pro podávání parenterální výživy je nutné zajištění adekvátního žilního vstupu.
Vaky parenterální výživy dělíme na tzv. periferní a centrální - podle toho, zda je možná aplikace do periferního žilního systému, anebo je nutné zajištění centrálního žilního vstupu. Centrální žilní vstup je přitom podmíněn uložením distálního konce katétru v oblasti kavoatriální junkce, tedy v místě, kde se vlévá dutá žíla do pravé srdeční síně. Je známo, že nedodržení podmínky centrální pozice katétru (např. při jeho zakončení v horní třetině horní duté žíly, případně v brachiocefalické žíle) je zatíženo zvýšeným rizikem trombotických komplikací a malfunkce katétru. K navigovanému zavedení katétru lze použít skiaskopii, ultrasonografii (včetně echografie), případně intravazální monitoraci EKG.48
Periferní aplikace parenterální výživy je indikována jen v případě nutnosti krátkodobé substituce (obecně do přibližně sedmi dní) nebo do doby zajištění centrálního žilního vstupu. Pro léčiva určená k nitrožilní aplikaci do periférie je nutno respektovat některá omezení, která jsou dána vlastností podávaných látek. Obecně je možno periferně podávat látky s pH v rozmezí 5-9, osmolaritou do 600 mosmol/l a léčiva, která nejsou riziková v případě extravazace nebo pro svůj vazoaktivní potenciál (zpuchýřující cytostatika, sympatomimetika atd.). U periferních vaků parenterální výživy jsme obecně benevolentnější, nicméně je nutné mít na paměti, že osmolarita periferní parenterální výživy je cca v rozmezí 750-900 mosmol/l (podle výrobce). Při dlouhodobější aplikaci do periférie proto narůstá riziko flebitidy a tromboflebitidy iritací endotelu.
Pro centrální aplikaci máme k dispozici čtyři druhy centrálních žilních katétrů: netunelizovanou centrální venózní kanylu, tunelizovanou centrální venózní kanylu (např. Broviacův katétr), centrální kanylu zavedenou z periférie (peripherally inserted central carheter, PICC) a venózní port.
Pro krátkodobou parenterální výživu (totální nebo doplňkovou) volíme nejčastěji zavedení netunelizované centrální venózní kanyly, která je indikována v případě nutnosti parenterální výživy na dobu jednoho až dvou týdnů. Zlatým standardem pro parenterální výživu je Broviacův katétr, který je tunelizován podkožím nejčastěji do oblasti přední hrudní stěny, dakronová manžeta v místě výstupu katétru postupně epitelizuje, a je tak branou proti vstupu infekce podél katétru. Katétr nabízí pacientovi nejlepší možnost samoobsluhy, životnost katétru je v řádu měsíců až let a je indikován zejména u nemocných s vizí dlouhodobé, mnohdy celoživotní závislosti na parenterální výživě (syndrom krátkého střeva apod.). Další volbou je inzerce PICC, který je označován za střednědobý žilní vstup. Jedná se o centrální žilní katétr, který je inzertován z periférie, nejčastěji z oblasti mediální strany paže (přístupem via v. basilica nebo v. brachialis). Je ideální u nemocných, u nichž je z různých důvodů indikována doplňková parenterální výživa anebo se jedná o pacienty, u kterých je plánována domácí PV. Z těchto důvodů má význam především v onkologické péči, kdy je PICC vstupem volby. Studie z posledních pěti let prokázaly významné snížení infekčních a trombotických komplikací při dodržení zásad pro inzerci a ošetřování PICC, které následně definovala Společnost pro porty a permanentní katétry.49 Má-li již pacient zaveden z indikace protinádorové terapie venózní port, lze tento vstup využít i pro podávání parenterální výživy.
DESET BODŮ PRO PRAXI
Modrá kniha České onkologické společnosti ČLS JEP definuje ve své poslední aktualizované verzi deset bodů pro onkologickou praxi, jejichž respektování na onkologických pracovištích může pozdvihnout nutriční péči na žádoucí úroveň:13
- Rozvoj významné podvýživy je u onkologických nemocných častý a tento fakt dokazují i opakované plošné průzkumy nutričního rizika této populace v ČR.
- Podvýživa má jasný vztah k prognóze onkologického pacienta, přičemž tzv. grading malnutrice přímo koreluje s mediánem očekávaného přežití.
- Podvýživa, zvláště v oblasti beztukové tělesné hmoty, má dopad nejen na kvalitu života a stav výkonnosti nemocných, ale zhoršuje i toleranci protinádorové léčby.
- Podvýživa je častým následkem protinádorové léčby, a i z pohledu iatrogenity si tak zaslouží aktivní intervenci.
- Série různých protinádorových intervencí vede k progresi malnutrice, která je v pokročilých stadiích řešitelná obtížněji, nákladněji a méně úspěšně než ve stadiu počátečním. Proto je cílem včasný záchyt nemocných již v tzv. prekachexii, což je důvodem k provádění vstupního nutričního screeningu.
- V týmu každého onkologického pracoviště je přítomen nutriční terapeut.
- V týmu každého onkologického pracoviště je přítomen onkolog s nadstavbovou nutriční licencí (tzv. licence F016), která jej opravňuje k předpisu umělé výživy i nad rámec dostupnosti každému onkologovi.
- Každé onkologické pracoviště úzce spolupracuje s nejbližší nutriční ambulancí a v zájmu dodržení časového harmonogramu léčby v něm mají onkologičtí pacienti zajištěny přednostní termíny.
- Onkologické pracoviště má zajištěný tým ke zřizování permanentních centrálních žilních vstupů a na úrovni sesterské dokonale zvládnutý sterilní management jejich používání, včetně specifik pro parenterální výživu.
- Lůžkové onkologické oddělení má k dispozici stabilní jednoduché portfolio umělé výživy, konkrétně:
- koncentrovaný (od 2 kcal/1 ml výše) maloobjemový proteinový sipping,
- polymerní enterální výživu 1,5 kcal/1 ml s vlákninou (tzv. energy fibre),
- parenterální all-in-one vaky o objemu 1 000 ml s pevným časovým řádem k aplikaci (např. od 20:00 do 6:00 hodin).
DOPORUČENÉ POSTUPY NUTRIČNÍ PÉČE U PACIENTŮ V ONKOLOGICKÉ PALIATIVNÍ PÉČI
V rámci paliativní péče rozlišujeme tři prognostické kategorie pacientů:50
- Pacienti léčení paliativní (nekurativní) protinádorovou léčbou s předpokládanou délkou přežití v řádu měsíců až několika let.
- Pacienti s vyčerpanou (ukončenou) protinádorovou léčbou, v relativně stabilizovaném stavu s předpokládanou délkou přežití v řádu měsíců.
- Pacienti s vyčerpanou (ukončenou) protinádorovou léčbou s progresivním zhoršováním celkového stavu nebo selháváním jedné nebo více vitálních orgánových soustav s předpokládanou délkou přežití v řádu dnů až týdnů; stav těchto pacientů je označován za „terminální“.
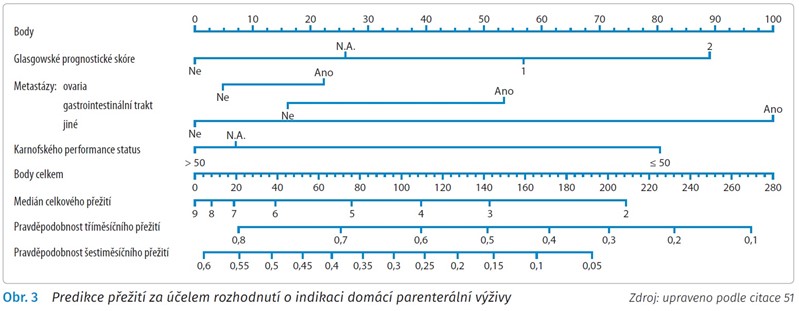
V první kategorii je indikována standardní nutriční podpora a léčba jako u ostatních pacientů s chronickým onemocněním. Specifický individuální přístup volíme u nemocných v druhé a třetí skupině, kde je cílem nutriční podpory udržení stávajícího nutričního a funkčního stavu, případně zpomalení zhoršování tohoto stavu. Stěžejním cílem je zlepšit nebo udržet kvalitu života a současně respektovat přání pacienta. Mnohdy není snadné rozhodnout, jak intenzivně v rámci nutriční podpory postupovat, zvlášť v případě rozhodování o indikaci domácí parenterální výživy. Byla vypracována celá řada nomogramů, které mohou být v rozhodovacím procesu nápomocny.51 Příklad takového nomogramu znázorňuje obr. 3.
Na základě stanovení Glasgowského prognostického skóre (Glasgow Prognostic Score, GPS), daného koncentrací C-reaktivního proteinu (CRP) a albuminu, typu malignity a výkonnostního stavu pacienta jsme schopni orientačně odhadnout dobu přežití pacienta (predikci ve 3 a 6 měsících). Jedná se však pouze o odhad a pravdou zůstává, že pro správnou volbu konkrétních postupů jsou zásadní především zkušenosti nutričního týmu.
ZÁVĚR
Žijeme v části světa, kde je plně dostupná možnost adekvátní nutriční intervence, a proto je na nás všech, abychom se toho snažili využít. Při kurativním způsobu léčby může mít udržení dobrého stavu výživy zásadní vliv na výskyt nežádoucích účinků, v paliaci může rozhodnout o kvalitě života a délce přežití, v symptomatické péči může být nutriční terapie stěžejní náplní zásad „best supportive care“, tedy symptomatické léčby se zvýšením kvality života. Pevně věřím, že česká onkologie má nakročeno správným směrem v boji s nutričním nihilismem.
LITERATURA
- https://www.linkos.cz/narodni-onkologicka- sit/kriteria-komplexnich-onkologickych- sluzeb/.
- Muscaritoli M, Molfino A, Gioia G, et al. The „parallel pathway“: a novel nutritional and metabolic approach to cancer patients. Internal and Emergency Medicine 2011; 6:105-112.
- Hébuterne X, Lemarié E, Michallet M, et al. Prevalence of malnutrition and current use of nutrition support in patients with cancer. J Parenter Enteral Nutr 2014;38:196-204.
- Lopes JP, et al. Nutritional status assessment in colorectal cancer patients. Nutr Hosp 2013;28:412-418.
- www.svod.cz.
- Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer incidence and mortality worldwide: IARC Cancer Base No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer, 2013. Dostupné na: http:// globocan.iarc.fr.
- Mošnová V, Šachlová M, Benešová V, et al. Nutriaction - nutriční screening v onkologických ambulancích. XXXV. brněnské onkologické dny. Poster. Číslo abstraktu: 212p.
- Vorlíček J, Holečková P; pracovní skupina nutriční péče v onkologii. Tisková konference České onkologické společnosti ČLS JEP 2. 6. 2015.
- Laviano A, et al. Nutritional issues in cancer management. Nutrition 1996;12:358-371.
- Prado CMM, Antoun S, Sawyer MB, et al. Two faces of drug therapy in cancer: drug related lean tissue loss and its adverse consequences to survival and toxicity. Current Opinion in Clinical Nutrition and Metabolic Care 2011;14:250-254.
- Antoun S, Baracos VE, Birdsell L, et al. Low body mass index and sarcopenia associated with dose-limiting toxicity of sorafenib in patients with renal cell carcinoma. Ann Oncol 2010;21:1594-1598.
- Prado CM, Baracos VE, McCargar LJ, et al. Body composition as an independent determinant of 5-fluorouracil-based chemotherapy toxicity. Clin Cancer Res 2007;13:3264-3268.
- Indikace nutriční podpory onkologicky nemocných. Modrá kniha České onkologické společnosti, 23. aktualizace. Dostupné na: https://www.linkos.cz/informace-pro-praxi/modra-kniha/30-indikace-nutricni-podpory-onkologicky- nemocnych/.
- Evans WJ, Morley JE, Argilés J, et al. Cachexia: A new definition. Clinical Nutrition 2008;27:793-799.
- Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12:489-495.
- Nicolini A, Ferrari P, Masoni MCh, et al. Malnutrition, anorexia and cachexia in cancer patients: A mini-review on pathogenesis and treatment. Biomedicine & Pharmacotherapy 2013;67:807-817.
- Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017;36:11-48.
- Cao DX, Wu GH, Zhang B, Quan YJ, Wei J, Jin H. Resting energy expenditure and body composition in patients with newly detected cancer. Clin Nutr 2010;29:72-77.
- Melstrom LG, Melstrom KA, Ding XZ, Adrian TE. Mechanisms of skeletal muscle degradation and its therapy in cancer cachexia. Histology and histopathology 2007;22:705-814.
- Madeddu C, Mantovani G. An update on promising agents for the treatment of cancer cachexia. Curr Opin Support Palliat Care 2009;3:258-262.
- Mateen F, Jatoi A. Megestrol acetate for the palliation of anorexia in advanced, incurable cancer patients. Clin Nutr 2006;25:711-715.
- Mantovani G, Maccio A, Madeddu C, et al. Randomized phase III clinical trial of five different arms of treatment in 332 patients with cancer cachexia. Oncologist 2010;15:200-211.
- McMillan DC, O’Gorman P, Fearon KC, McArdle CS. A pilot study of megestrol acetate and ibuprofen in the treatment of cachexia in gastrointestinal cancer patients. Br J Cancer 1997;76:788-790.
- Sarcopenia: European consensus on definition and diagnosis. Report of the European Working Group on Sarcopenia in Older People. Age and Ageing 2010; 39:412-442.
- Prado CM, Lieffers JR, McCargar LJ, et al. Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study. Lancet Oncol 2008;9;629-635.
- Lieffers JR, Bathe OF, Fassbender K, Winget M, Baracos VE. Sarcopenia is associated with postoperative infection and delayed recovery from colorectal cancer resection surgery. Br J Cancer 2012;107:931-936.
- Mourtzakis M, Prado CM, Lieffers JR, et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab 2008;33:997-1006.
- Martin L, et al. CT images. J Clinical Oncology 2013;31:1539-1547.
- Gianotti L, Braga M, Nespoli L, et al. A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer. Gastroenterology 2002;122:1763-1770.
- Maňásek V, Bezděk K, Foltys A, et al. The impact of high protein nutritional support on clinical outcomes and treatment costs of patients with colorectal cancer. Clin Oncol 2016;29:351-357.
- The Eastern Cooperative Oncology Group. Prognostic effect of weight loss prior to chemotherapy in cancer patients. American Journal of medicine 1980;69:491-497.
- Awad S, Tan BH, Cui H, et al. Marked changes in body composition following neoadjuvant chemotherapy for oesophagogastric cancer. Clin Nutr 2012;31:74-77.
- Kurk S, Peeters PHM, Stellato RK, et al. Impact of skeletal muscle index (SMI) loss during palliative systemic treatment (Tx) on time to progression and overall survival (OS) in metastatic colorectal cancer (mCRC) patients. J Clin Oncol 2017;35:15(suppl):10087.
- Kondrup J, Rasmussen HH, Hamberg O, Stanga Z, Ad Hoc ESPEN Working Group. Nutritional risk screening (NRS 2002): a new method based on analysis of controlled clinical trials. Clin Nutr 2003;22:321-336.
- https://www.linkos.cz/pracovni-skupina- nutricni-pece-v-onkologii-pri-cos/materialy-pro-praxi-ke-stazeni/.
- https://www.linkos.cz/lekar-a- multidisciplinarni-tym/diagnostika-a-lecba/modra-kniha-cos/aktualni-vydani-modre- knihy/23-30-indikace-nutricni-podpory- onkologicky-nemocnych/.
- Pironi L, Arends J, Bozzetti F, et al. ESPEN Cancer Guidelines 2016. Clin Nutr 2016;35:247-307.
- Martin L, Senesse P, et al. Diagnostic criteria for the classification of cancer-associated weight loss. J Clin Oncol 2015;33:90-99.
- http://www.skvimp.cz/?action=changecategory&value=34.
- Atasoy BM, Yonal O, Demirel B, et al. The impact of early percutaneus endoscopic gastrostomy placement on treatment completeness and nutritional status in locally advanced head and neck patients receiving chemoradiotherapy. Eur Arch Otorhinolaryngol 2012;269:275-282.
- Vaughan VC, Martin P, Lewandowski PA. Cancer cachexia: impact, mechanisms and emerging treatments. J Cachexia Sarcopenia Muscle 2013;4:95-109.
- Peterson DE, Bensadoun R-J, Roila F. Management of oral and gastrointestinal mucositis: ESMO Clinical Practice Guidelines. Ann Oncol 2011;22(suppl 6):vi78-vi84.
- http://www.linkos.cz/informace-pro-praxi/modra-kniha/26-zasady-prevence-a-lecby- nevolnosti-a-zvraceni-po-protinadorove- lecbe/.
- Maňásek V. Stav výživy onkologicky nemocných a efekt nutriční intervence v ČR. Nutrition news 2016;4:28-30.
- Beneš P. Role parenterální výživy v podpůrné onkologické léčbě - nový pohled. Acta Medicinae 2014;8:67-71.
- Allingstrup MJ, Esmailzadeh N, Wilkens Knudsen A, et al. Provision of protein and energy in relation to measured requirements in intensive care patients. Clin Nutr 2012;31:462-468.
- Hoffer LJ. How much protein do parenteral amino acid mixtures provide? Am J Clin Nutr 2011;94:1396-1398.
- Charvát J, a kol. Žilní vstupy. Praha: Grada Publishing, 2016.
- http://www.sppk.eu/?page_id=488.
- Šachlová M, Tomíška M, Sláma O. Doporučené postupy: Nutriční péče u pacientů v onkologické paliativní péči. Stanovisko Pracovní skupiny pro výživu České společnosti paliativní medicíny ČLS JEP.
- Bozzetti F, Cotogni P, LoVullo S, et al. Development and validation of a nomogram to predict survival in incurable cachectic cancer patients on home parenteral nutrition. Ann Oncol 2015;26:2335-2340.