Olaparib jako udržovací léčba nově diagnostikovaných pacientek s karcinomem ovarií - výsledky studie SOLO1
01/2022
MUDr. Klaudia Regináčová; doc. MUDr. Martina Kubecová, Ph.D.
Radioterapeutická a onkologická klinika 3. LF UK a Fakultní nemocnice Královské Vinohrady, Praha
SOUHRN
Karcinom ovaria patří dlouhodobě mezi onemocnění s nejistou prognózou a vysokou mortalitou. S postupujícími poznatky se ukazuje význam inhibice poly(ADP-ribóza) polymerázy (poly[ADP-ribose] polymerase, PARP) v terapii onemocnění. Studie SOLO1 u nově diagnostikovaného pokročilého karcinomu ovaria prokázala benefit olaparibu jako udržovací léčby ve výrazném zlepšení přežití bez nemoci při dobré kvalitě života pacientek.
Klíčová slova
karcinom ovaria, mutace BRCA, olaparib, studie SOLO1, udržovací léčba
SUMMARY
The ovarian cancer has been a disease with an uncertain prognosis and a high mortality for a long time. The importance of poly(ADP-ribose) polymerase (PARP) inhibition in its treatment was clearly proved. The SOLO1 study in a newly diagnosed advanced ovarian cancer demonstrates the benefit of olaparib as a maintenance treatment, significantly improving progression free survival with a good quality of life for patients.
Key words
ovarian cancer, BRCA mutation, olaparib, SOLO1 study, maintenance therapy
ÚVOD
V léčbě karcinomu ovarií byla dlouhou dobu nej po užívanější léčebnou modalitou chemoterapie a nejpoužívanějším cytostatikem byl a dosud je platinový derivát. Léta se hledala ještě další přídavná nebo alternativní léčba, která by u pacientek zlepšila prognózu onemocnění. S lepším poznáním samotného onemocnění a s prohloubením znalostí v oblasti molekulární diagnostiky byly objeveny vhodné cíle, které by bylo možno v léčbě využít.
Víme, že karcinom ovarií patří k častým nádorovým onemocněním. V České republice v roce 2018 byla jeho incidence 17,72 případů na 100 000 obyvatel. Mortalita zůstává poměrně vysoká - 11,8 případů na 100 000 obyvatel. Ze všech gynekologických nádorů je bohužel mortalita nejvyšší. V posledních letech je patrný pomalý mírný sestupný trend incidence i mortality.
U většiny pacientek (kolem 75 %) je karcinom ovarií diagnostikována ve III. A IV. stadiu onemocnění. Histologicky se většinou jedná o high-grade serózní karcinom. Každá pacientka diagnostikovaná s karcinomem ovarií by měla být prodiskutována v rámci multidisciplinárního týmu s návrhem léčebného postupu.1
GENETICKÁ PREDISPOZICE K ONEMOCNĚNÍ
Každá pacientka by také již při diagnostice onemocnění měla být odeslána ke genetickému vyšetření. Celoživotní riziko vzniku karcinomu ovarií je nižší než 2 %, u geneticky predisponovaných pacientek se toto riziko ale výrazně zvyšuje. Právě genetická predispozice je vysoce rizikovým faktorem pro vznik karcinomu ovarií. Asi u třetiny až pětiny pacientek vzniká onemocnění na základě zděděné predispoziční mutace - nejčastěji v genu BRCA1 nebo BRCA2, méně často v genech pro opravu chybného párování bází (mismatch repair geny). Významnou roli zde hrají mutace v genech pro homologií řízenou opravu (homology-directed repair, HDR) (např. RAD51, CHEK2, ATM, PALB2), tj. dochází k poruše homologní rekombinace. V poslední době se proto častěji mluví o HDR deficientních a suficientních pacientkách. Predispozice k onemocnění karcinomem ovarií v případě mutace genů BRCA1 nebo BRCA2 je zjišťována v rámci syndromu hereditárního karcinomu prsu a ovarií. Celoživotní riziko vzniku karcinomu ovarií u nosiček BRCA1 je kolem 40-60 %, u nosiček BRCA2 je nižší, tj. 10-30 %. Riziko vzniku onemocnění je již v mladším věku - u BRCA1 začíná stoupat po 35. roku a u BRCA2 po 50. roku. U obou mutací je dominujícím histologickým typem high-grade serózní karcinom. Pacientky s BRCA mutací mají také větší citlivost k chemoterapii platinovým derivátem.2'3
Každý den v buňce vznikají tisíce jednovláknových zlomů DNA. Tyto zlomy mohou být opraveny enzymy ze skupiny poly(ADP-ribóza) polymerázy (poly[ADP-ribose] polymerase, PARP). Neopravené jednovláknové zlomy vedou k poruše replikační vidlice a následnému vzniku dvouvláknových zlomů. Nádorové buňky s BRCA mutacemi nedokážou tyto zlomy opravit a dochází k úmrtí buňky. V kombinaci s látkami poškozujícími DNA (chemoterapie, záření) se tento účinek ještě znásobí.4
PRIMÁRNÍ LÉČBA
Pacientky s nově diagnostikovaným karcinomem ovaria jsou po primární léčbě - operaci a chemoterapii - ohroženy relapsem onemocnění. Významný přínos pro přežití nemocných má operace s makroskopicky nulovým reziduem, toho je však ne vždy i přes podání neoadjuvantní chemoterapie dosaženo. U cca 70 % pacientek dochází k relapsu během tří let od zahájení léčby první linie.5 Pacientky s relabujícím onemocněním často absolvují několik linií chemoterapie, které jsou často spojeny s kumulativní toxicitou a zkracováním období remisí. Medián do prvního symptomatického relapsu onemocnění po skončení léčby první linie je 18 měsíců, ale u třetího relapsu je to již jen kolem 6 měsíců. Relabující onemocnění snižuje kvalitu života pacientky a ovlivňuje její fyzickou aktivitu.6-8
OLAPARIB - STUDIE SOLO1
Hledají se proto ještě další možnosti ke zlepšení prognózy pacientek. Tuto novou naději přinášejí výsledky studie SOLO1 - randomizované, dvojitě zaslepené studie fáze 3, která zkoumala význam PARP inhibitoru olaparibu jako udržovací léčby u nově diagnostikovaného pokročilého karcinomu ovaria. Tato studie vycházela z výsledků výzkumu olaparibu u platina senzitivního relapsu onemocnění. Do studie byly zařazeny pacientky s nově diagnostikovaným karcinomem ovaria stadia FIGO III-IV se serózním nebo méně často endometroidním ovariálním karcinomem a primárním peritoneálním karcinomem. Všechny pacientky měly potvrzenou somatickou nebo germinální BRCA mutaci a byly v dobrém klinickém stavu (performance status, PS) 0-1 podle World Health Organization (WHO). Podstoupily léčbu chemoterapií založenou na platinovém derivátu a cytoredukční operaci s dosažením klinicky kompletní nebo částečné odpovědi. Pacientky byly randomizovány v poměru 2 : 1 do ramene s olaparibem v dávce 300 mg 2x denně oproti rameni s placebem. Stratifikovány byly podle odpovědi na chemoterapii na bázi platiny. Hodnocená léčba probíhala až do progrese onemocnění. U pacientek, u kterých nebyly přítomny žádné známky onemocnění, byla léčba ukončena po dvou letech. U pacientek s částečnou odpovědí léčba i po dvou letech pokračovala. Primárním cílem studie bylo přežití bez progrese (progression free survival, PFS).
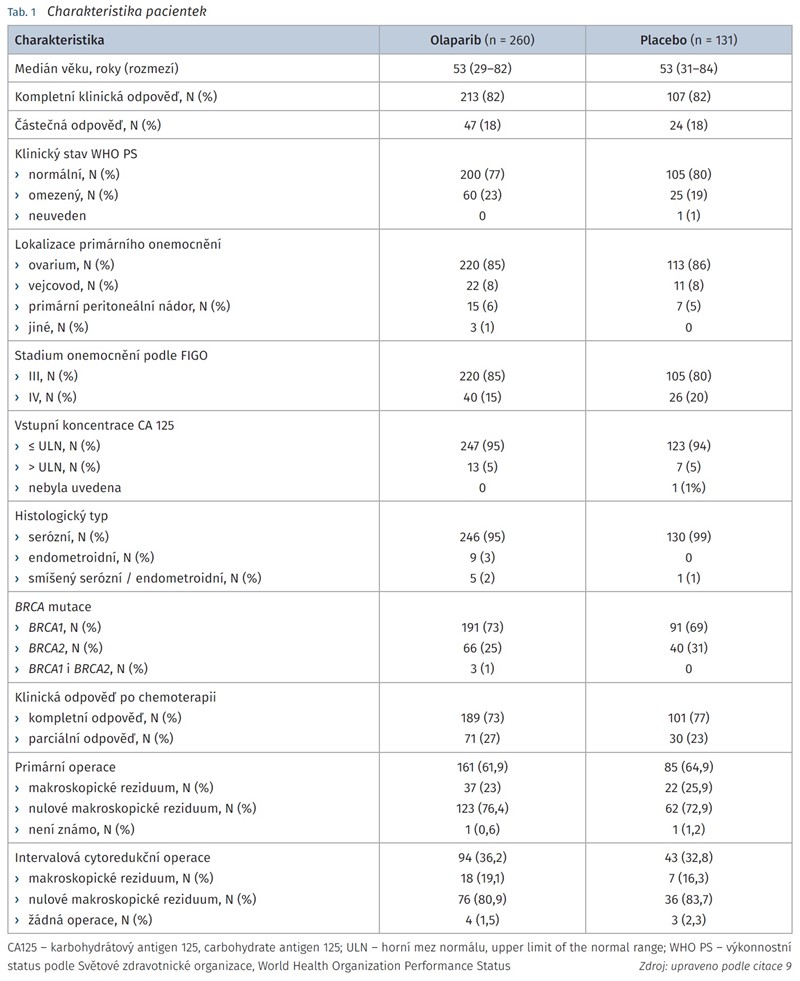
Do studie bylo zařazeno celkem 391 pacientek z 15 zemí světa. Charakteristika pacientek v rameni s účinnou látkou i v rameni s placebem byla vyvážená. Bližší charakteristika pacientek je uvedena v tab. 1. Kompletní a částečné klinické odpovědi na chemoterapii na bázi platiny dosáhlo 213 (82 %) a 47 (18 %) pacientek zařazených do ramene s účinnou látkou a 107 (82 %) a 24 (18 %) pacientek zařazených do ramene s placebem. Téměř 90 % pacientek bylo léčeno chemoterapií carboplatinou a paclitaxelem, většinou absolvovaly 6 cyklů léčby.
Medián sledování pacientek byl v rameni s olaparibem oproti rameni s placebem 40,7 měsíce vs. 41,2 měsíce, přičemž medián celkové doby trvání léčby byl 24,6 měsíce vs. 13,9 měsíce. Podle protokolu po dvou letech ukončilo léčbu 47 % vs. 70,8 % pacientek.
V roce 2018 byly prezentovány první výsledky studie a byl prokázán přínos v udržovací léčbě první linie. Na základě těchto výsledků se v mnohých zemích olaparib začal požívat v praxi. Po třech letech trvání studie nebylo v rameni s olaparibem dosaženo PFS, v rameni s placebem bylo 13,8 měsíce. Riziko progrese onemocnění nebo úmrtí bylo u pacientek s olaparibem o 70 % nižší než u pacientek s placebem (poměr rizik [hazard ratio, HR] 0,30; p < 0,001). Když srovnáme obě ramena, po třech letech zůstává bez progrese onemocnění 60 % pacientek na olaparibu, ale jenom 27 % na placebu. V rameni s olaparibem bylo pozorováno snížení rizika druhé progrese (HR 0,46), přičemž udržovací léčba nesnižuje přínos plynoucí z následné terapie. Byly publikovány i výsledky po pětiletém sledování. V rameni s olaparibem bylo více než 50 % pacientek bez recidivy onemocnění (podskupina s kompletní remisí), medián PFS byl 56 měsíců (HR 0,333). Olaparib významně snížil riziko progrese onemocnění či úmrtí o 67 % a významně prodloužil medián PFS ve srovnání s placebem (56,0 vs. 13,8 měsíce). Interval bez recidivy (recurrence free interval) v podskupině s kompletní remisí zatím nebyl dosažen, v rameni s placebem byl 15,3 měsíce (HR 0,37).9 Po pěti letech nebyly nalezeny známky progrese choroby u 48 % pacientek užívajících olaparib oproti 21 % v placebové skupině. Zlepšení PFS bylo patrné i u pacientek bez BRCA mutace, rozdíl byl však méně významný.10
Nežádoucí příhody grade 3 nebo 4 byly častější v rameni s olaparibem oproti placebu, 39 % vs. 18 %. Asi 12 % pacientek v rameni s olaparibem ukončilo léčbu z důvodu toxicity, nejčastější příčinou byla nauzea nebo anemie. Nejčastější hematologické nežádoucí účinky byly anemie, neutropenie a trombocytopenie. Asi v 1 % se v rameni s olaparibem vzácně vyskytly myelodysplastický syndrom / akutní myeloidní leukemie (myelodysplastic syndrome / acute myeloid leukemia, MDS/AML), nová malignita nebo pneumonitida. Mezi další nežádoucí příhody patřily nevolnost, únava, zvracení, průjem nebo zácpa. V případě nežádoucích účinků tři ze čtyř pacientek pokračovaly v užívání doporučené počáteční dávky. Většina nežádoucích účinků se objevila během prvních tří měsíců terapie. Ve srovnání kvality života nebyl mezi oběma rameny významný rozdíl.9
ZÁVĚR
Výsledky studie SOLO1 poukazují na důležitost udržovací léčby především v první linii. Ta je pro pacientku klíčová a ve své podstatě jediná s kurativním záměrem. Léčba olaparibem nejen významně prodlužuje PFS u BRCA mutovaných pacientek, ale také je zachována dobrá kvalita jejich života. Studie poukazuje na důležitost potvrzení somatické i germinální BRCA mutace genetickým vyšetřením.
LITERATURA
- Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice. Verze 7.0 [online]. Masarykova univerzita, 2005. Dostupné na: http://www.svod.cz
- Wang Q. Cancer predisposition genes: molecular mechanisms and clinical impact on personalized cancer care: examples of Lynch and HBOC syndromes. Acta pharmacologica Sinica 2016;37:143-149.
- Neff RT, Senter L, Salani R. BRCA mutation in ovarian cancer: testing, implications and treatment considerations, Ther Adv Med Oncol 2017;9:519-531.
- Cortez AJ, Tudrej P, Kujawa KA, Lisowska KM. Advances in ovarian cancer therapy. Cancer Chemother Pharmacol 2018;81:17-38.
- Kurta ML, Edwards RP, Moysich KB, et al. Prognosis and conditional disease-free survival among patients with ovarian cancer. J Clin Oncol 2014;32:4102-4112.
- Hall M, Savvatis K, Nixon K, et al. Maximal-effort cytoreductive surgery for ovarian cancer patients with a high tumor burden: variations in practice and impact on outcome. Ann Surg Oncol 2019;26:2943-2951.
- Bookman MA, Brady MF, Mutch DG, et al. Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a phase III trial of the Gynecologic Cancer InterGroup. J Clin Oncol 2009;27:1419-1425.
- Ledermann JA, Sessa C, Colombo N; ESMO Guidelines Committee. Appendix 7: Ovarian cancer: eUpdate published online September 2016 (http://www.esmo.org/Guidelines/Gynaecological-Malignancies). Ann Oncol 2016;27(Suppl 5):v145.
- Moore K, Colombo N, Scambia G, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2018;379:2495-2505.
- Colombo N, Bradley W, Moore K, et al. 392 Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation: subgroup analysis by risk in the phase III SOLO1 study. Int J Gynecol Cancer 2020;30:A76-A77.