Venetoklax - nová naděje pro pacienty s CLL v relapsu onemocnění
06/2018
Symposium na toto téma, sponzorované farmaceutickou společností AbbVie, se konalo v rámci 1. českého hematologického a transfuziologického sjezdu v Praze v září 2018. Nejnovější poznatky o tomto onemocnění, jeho incidenci, prevalenci a přežívání pacientů, o nových přípravcích sloužících k jeho cílené léčbě, o výsledcích klinických studií a také některé kasuistiky zde prezentovali prof. MUDr. Marek Trněný, DrSc., (I. interní klinika hematologie 1. LF UK a VFN Praha), prof. MUDr. Michael Doubek, Ph.D. (Masarykova univerzita Brno, CEITEC, Interní hematologická a onkologická klinika FN Brno) a prim. MUDr. Martin Špaček, Ph.D. (I. interní klinika hematologie 1. LF UK a VFN Praha).
ÚVOD
Chronická lymfocytární leukemie (CLL) neboli nádorové onemocnění kostní dřeně a krve je nejčastějším leukemickým onemocněním dospělých v západním světě. Jde o pomalu progredující lymfoproliferativní onemocnění, jehož podstatou je klonální proliferace maligně transformovaných vyzrálých lymfocytů (v 95 % B lymfocytů). Tyto lymfocyty nepodléhají apoptóze tak rychle, jako jejich fyziologické protějšky, a jejich postupné zmnožování je způsobováno nejen nekontrolovanou proliferací, ale především poruchou jejich zániku procesem apoptózy. V patogenezi choroby se uplatňuje zvýšená exprese genu BCL-2; právě ona způsobuje inhibici apoptózy patologických lymfocytů. Chronická lymfocytární leukemie postihuje zpravidla starší a komorbidní osoby (průměrný věk v době diagnózy se pohybuje v rozmezí 65-72 let), ale nejen je; kolem 30 % pacientů je mladších než 60 let. Onemocnění je charakterizováno velmi heterogenním průběhem a délkou přežití od několika měsíců po desítky let. Řada nemocných (přibližně polovina) vůbec nedospěje k nutnosti zahájit terapii, protože nemají žádné příznaky vyplývající z CLL; docházejí pouze na pravidelné kontroly. U části nemocných je po různě dlouhém období nutno léčbu zahájit, pokud dojde k poklesu červených krvinek či krevních destiček, k výraznému zvětšení mízních uzlin či sleziny nebo k rozvoji příznaků způsobených tímto onemocněním (zejména výrazné noční pocení, horečky neinfekčního původu, hubnutí či výrazná únava). U určité relativně úzké skupiny pacientů má však onemocnění velmi nepříznivý průběh a špatnou prognózu, a to i bez ohledu na opakované terapie. Vzhledem k této mimořádné klinické variabilitě a s ohledem na nové léčebné možnosti je nutno zpřesnit individuální prognózu nemocných. V posledních letech přibyly zásadní poznatky týkající se posouzení prognózy onemocnění (významné genetické aberace, mutace genu TP53, mutační stav genů pro variabilní část těžkého řetězce imunoglobulinu). Objevuje se též řada nových terapeutických molekul s odlišnými mechanismy účinku (nové monoklonální protilátky, inhibitory drah B-buněčného receptoru a nejnověji antagonisté antiapoptotického proteinu BCL-2), které zásadním způsobem zasahují do léčebných postupů u nemocných s CLL. Jejich prvním představitelem je venetoklax.
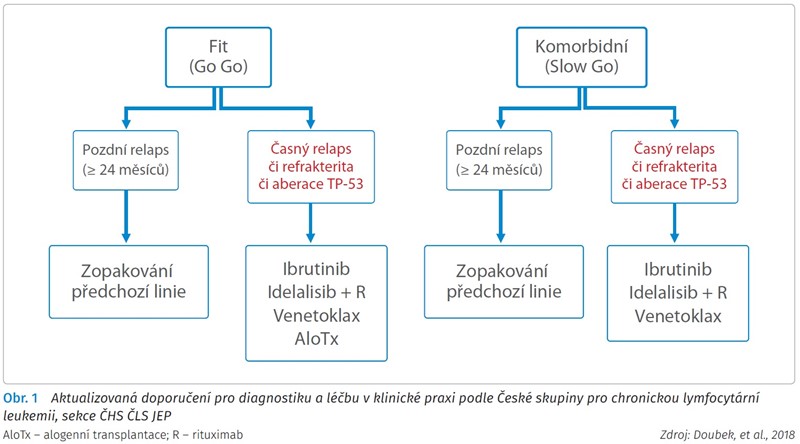
V reakci na tuto situaci vytvořila Česká skupina pro chronickou lymfocytární leukemii, sekce České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČHS ČLS JEP), aktualizovaná doporučení pro diagnostiku a léčbu v klinické praxi (obr. 1).
INCIDENCE, PREVALENCE, PĚTILETÉ RELATIVNÍ PŘEŽÍVÁNÍ
V úvodu symposia se profesor Trněný krátce zmínil o epidemiologii CLL v České republice.
Chronická lymfocytární leukemie je z pohledu incidence druhou a z pohledu prevalence třetí nejčastější hematologickou malignitou u nás. V letech 2012-2016 bylo v ČR ročně diagnostikováno průměrně 649 nových pacientů a dnes žije v Česku s tímto onemocněním nebo jeho historií více než 4 500 osob. Za posledních dvacet let (konkrétně v letech 1990-1994) se naštěstí výrazně zlepšilo pětileté relativní přežití těchto pacientů - u léčených to bylo z 38 na více než 50 %, u celé skupiny pacientů vzhledem k povaze onemocnění ještě více - z 50 na 63 %.
Relabující - refrakterní chronická lymfocytární leukemie
Nicméně je řada pacientů, u nichž dochází k relapsu. Léčebné strategie se u těchto pacientů odvíjejí od délky remise po poslední linii léčby a/anebo přítomnosti rizikových znaků jako delece 17p nebo mutace genu TP53. Zejména u pacientů s delecí 17p nebo mutací TP53 a/anebo krátkým trváním remise jsou indikovány nové léky ze skupiny inhibitorů dráhy B buněčného receptoru (ibrutinib a idelalisib) a inhibitor BCL-2 (venetoklax).
Subklonální a klonální vývoj
Problém relapsů u CLL spočívá v tom, že zde probíhá proces subklonálního a klonálního vývoje, během něhož se objevuje rezistentní klon a v okamžiku nasazení terapie (většinou imunochemoterapie) sice dojde k odpovědi, ale současně i k selekčnímu tlaku na klon, který nese některou z nepříznivých charakteristik. Dochází rychle k dalšímu relapsu a prognóza nemocného se zhoršuje. Velmi důležitá práce brněnských kolegů ukázala, že zatímco u neléčených pacientů je pravděpodobnost (kumulativní incidence) nepříznivých změn poměrně nízká (i když existuje), u léčených je tato kumulativní incidence poměrně vysoká (přičemž můžeme diskutovat o tom, zda jde jen o selekční vliv samotné terapie, anebo zda již to, že jsou indikováni k léčbě, je samo o sobě nepříznivým faktorem).
APOPTÓZA, JEJÍ REGULACE AVENETOKLAX
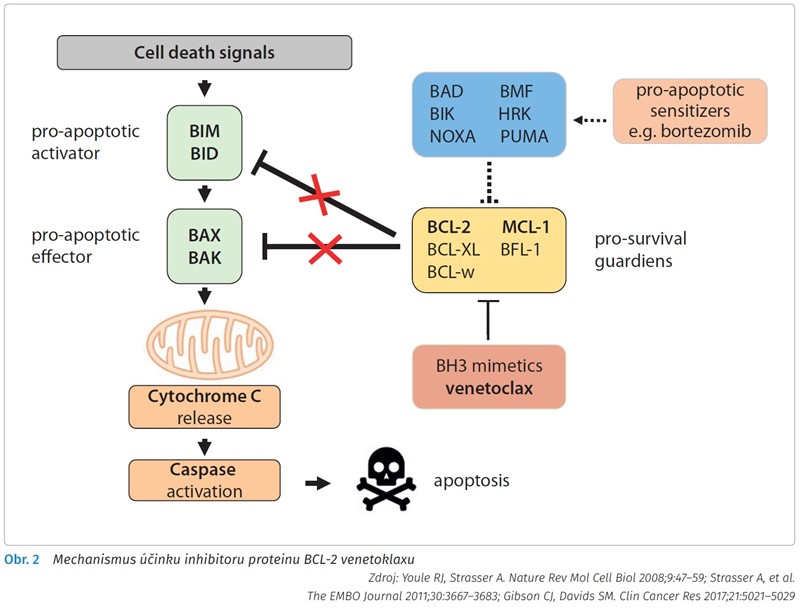
Na závěr své přednášky ještě profesor Trněný popsal funkci venetoklaxu při obnově apoptózy, která se v CLL buňkách nemůže spustit, kvůli „overexpresi“ antiapoptotických proteinů. Klíčovým regulátorem apoptotického procesu je skupina proteinů BCL-2 rodiny. K nim patří proteiny zodpovědné za aktivaci apoptózy (proapoptotické - BAX, BAK, BAD, BIM, PUMA), ale i proteiny, které apoptóze brání (antiapoptotické, prosurvival - BCL-2, BCL-XL, BCL-W, MCL-1, BFL-1). Při overexpresi prosurvival proteinu BCL-2 dochází k vychytání proapoptotických proteinů (BAX, BAD, BIM), tím pádem nemůže dojít k narušení mitochondriálni membrány a uvolnění cytochromu C, prvního kroku v apoptotické kaskádě. Venetoklax blokuje BCL-2, v místě BH3 domény (proto je někdy označován i jako BH3 mimetikum) uvolňuje proapoptotické aktivátory (BIM, BID) a proapoptotické efektory (BAX, BAK), které vedou k uvolnění cytochromu C z mitochondrií, k aktivací kaspáz a k apoptóze (obr. 2).
Venetoklax byl v Evropě schválen v roce 2016 jako první lék, který selektivně inhibuje funkci antiapoptotického proteinu BCL-2. Podává se per os jedenkrát denně, přičemž jeho další výhodou je, že působí nezávisle na TP53.
Venetoklax je indikován:
v monoterapii u pacientů s CLL s delecí chromosomu 17p nebo s mutací genu TP53 u dospělých pacientů nevhodných k léčbě inhibitorem dráhy B buněčného receptoru, nebo u těch, kde tato léčba selhala.
v monoterapii u dospělých pacientů s CLL s absencí delece chromosomu 17p nebo mutace genu TP53, u nichž selhala jak chemoimunoterapie, tak léčba inhibitorem dráhy B buněčného receptoru.
V následující přednášce se profesor Doubek věnoval problematice selhání léčby inhibitory dráhy B-buněčného receptoru. Diskutovány byly i zkušenosti s léčbou venetoklaxem v podmínkách běžné klinické praxe.
PŘÍČINY SELHÁNÍ LÉČBY INHIBITORY DRÁHY B BUNĚČNÉHO RECEPTORU (BCRI)
Při pohledu na 16 let stará data přežívání pacientů s CLL vidíme velmi špatné přežívání pacientů, u nichž selhala léčba alkylačními látkami, a ještě horší tam, kde selhala léčba fludarabinem. Postupně se do léčby CLL uvádějí nové cílené léky ze skupiny inhibitorů dráhy B-buněčného receptoru - ibrutinib (inhibitor BTK - Brutonovy thyrozinkinázy) a idelalisib (inhibitor PI3K5 - fosfatidylinositol-3-kinázy delta) a nejnověji i inhibitory BCL-2, jejímž jediným představitelem je venetoklax. Bohužel však i při léčbě ibrutinibem a idelalisibem dochází časem k relapsu onemocnění. Richterova transformace je příčinou selhání až u 8 % pacientů léčených BCRi. Za progresí CLL je často rezistence na ibrutinib způsobená mutacemi genů BTK a PLCg, které se objevují v průběhu subklonální a klonální evoluce, a to až u 87 % případů. Tyto a další mutace vedou k negativnímu ovlivnění vazby léku, autonomní signalizaci, aktivaci alternativních drah nebo up-regulaci antiapoptotických cest. Mezi další negativní predisponující faktory relapsu při léčbě BCRi patří vyšší věk, více než tři předchozí linie léčby v anamnéze a přítomnost delece 17p, komplexní karyotyp, který se zdá hraje významnější roli při léčbě ibrutinibem.
Přežití u pacientů po selhání inhibitoru dráhy B buněčného receptoru
Prognóza pacientů léčených ibrutinibem, u kterých došlo k transformaci, je velmi špatná, stejně tak nepříznivé je přežití u pacientů v důsledku progrese. U nemocných, kde je léčba vysazena z důvodů toxicity, je přežití lepší.
DŮVODY UKONČENÍ TERAPIE IBRUTINIBEM/IDELALISIBEM
Profesor Doubek dále prezentoval analýzu důvodů ukončení terapie ibrutinibem a idelalisibem z databáze CLLEAR České CLL skupiny. Při léčbě ibrutinibem je časné vysazení pozorováno častěji u pacientů, jimž je léčba nasazena později. Důvodem časného ukončení léčby ibrutinibem je přibližně v podobném počtu toxicita léčby a progrese či úmrtí. U idelalisibu je procento časných vysazení rozprostřeno poněkud odlišně; zde je to převážně z důvodu nehematologické toxicity, která je vyšší než u ibrutinibu, a též se nezdá, že by výskyt časných ukončení léčby nějak souvisel s předléčeností pacientů léčených idelalisibem.
U pacientů, kde z nějakých důvodů nové léky selhávají nebo navzdory nim dochází k další progresi, přichází ke slovu venetoklax.
VENETOKLAX V BĚŽNÉ KLINICKÉ PRAXI
Při zahájení léčby venetoklaxem je důležité správné dávkování (postupné zvyšování dávky v prvních týdnech), neboť první studie fáze I ukázala, že při rychlejším zvyšování dávky roste riziko lýzy tumoru. Postupné zvyšování dávky vedlo k eliminaci syndromu lýzy tumoru, původně spojeného se zahájením léčby.
V klinických studiích s venetoklaxem u pacientů s delecí 17p byl pozorován rychlý nástup odpovědi na léčbu, přičemž medián přežití bez progrese byl 27,2 měsíce. Podobně v klinické studii, kde byli zařazeni pacienti se selháním léčby po BCRi, byl medián přežití bez progrese 24,7 měsíce. Dalším znakem léčby venetoklaxem je vysoké procento dosažení negativity minimální reziduální nemoci i u pacientů s uvedenými rizikovými faktory.
V letošním roce byly publikovány výsledky retrospektivní analýzy 141 pacientů z USA, kteří byli léčeni venetoklaxem v běžné praxi. Medián věku při nasazení venetoklaxu byl 67 let. Téměř 45 % pacientů mělo deleci 17p, 44 % mutaci TP53, 27 % komplexní karyotyp, velká část pacientů léčených předtím ibrutinibem mělo mutaci BTK (35,3 %) nebo PLCy2 (12,5 %). A jaké byly léčebné odpovědi? Hodnotitelných bylo 129 pacientů, ve všech skupinách (věk nad nebo do 65 let, s defektem i bez mutace TP53, předléčených ibrutinibem nebo jinými léky, s mutací BTK nebo bez ní atd.) bylo dosaženo celkově vysokého počtu objektivních odpovědí 72 % (overall response rate, ORR) a poměrně vysokého procenta kompletních remisí 19 %. Vysoké procento objektivních odpovědí a kompletních remisí bylo pozorováno u všech výše zmíněných skupin pacientů. Pacienti s mutací TP53, byť užívali venetoklax, měli 2,7krát vyšší riziko progrese než pacienti, kteří tuto mutaci nemají.
Dále byly prezentovány výsledky pacientů léčených venetoklaxem z databáze CLLEAR. U 12 pacientů (ORR 86 %), jimž byl venetoklax podán ve 2.-8. linii léčby, byla zaznamenána kompletní či parciální remise, k progresi zatím došlo u dvou nemocných léčených venetoklaxem.
Na rozdíl od BCR inhibitoru nebylo zaznamenáno ukončení léčby kvůli toxicitě. Je třeba poznamenat, že soubor obsahuje zatím relativně málo pacientů léčených venetoklaxem.
Na závěr symposia se primář Špaček podělil o zkušenosti s léčbou venetoklaxem z jejich pracoviště.
Kasuistika 1
Pacientem byl muž (narozený v roce 1950), s nepříznivými prognostickými faktory (nemutovaný stav IgVH, del(17p), del(11q), del(13q), a významnými komorbiditami CIRS 10 (ischemická choroba srdeční, koronární bypass, fibrilace síní, implantace kardioverteru-defibrilátoru, plicní hypertenze, diabetes mellitus 2. typu; arteriální hypertenze). Diagnóza CLL byla stanovena v roce 2012, přičemž pacient byl tři roky v observaci. V dubnu 2015 došlo k progresi do Rai IV s masivní splenomegalií (25 cm), bulky masou v retroperitoneu (paket uzlin 8 x 5 x 18 cm). Z těchto důvodů byla v červenci 2015 zahájena léčba. V 1. linii léčby byla zvolena s ohledem na deleci 17p a komorbidity varianta rituximab + idelalisib. Podařilo se dosáhnout parciální remise s pouze hraniční splenomegalií (16 cm), pacient byl bez lymfadenopatie, uzliny prakticky vymizely. Účinek léčby byl tedy velmi dobrý, avšak asi po roce a půl došlo k těžké autoimunitní pankolitidě, která si vyžádala hospitalizaci. Pacientovi byla po vyloučení infekčních příčin podána terapie kortikosteroidy, na kterou během dvou dnů reagoval. Poté byl vzhledem k předchozímu velmi dobrému účinku léčby idelalisib em učiněn nový pokus o jeho nasazení, ale vzhledem k tomu, že se opět objevila kolitida, bylo nutno v únoru 2017 tuto terapii definitivně ukončit. Z úvah o další terapii byl zvolen venetoklax.
Toto rozhodnutí podporovaly i výsledky retrospektivní analýzy od autorů Mato a spol., která ukázala, že po BCRi nemá smysl podávat chemoimunoterapii. Při sekvenci léčby ibrutinib -4 idelalisib bylo ORR 46 %; idelalisib -4 ibrutinib ORR 75 % a při sekvenci inhibitor BCR -4 venetoklax ORR 74 %, zároveň 32 % pacientů dosáhlo i kompletní remise.
Venetoklax byl podáván od května 2017, jako prevence lýzy tumoru byla prováděna titrace dávky (20, 50, 100, 200, 400 mg denně, díky nepřítomnosti leukocytózy, a tedy nízkému riziku nádorového rozpadu ambulantně). Jestliže před léčbou venetoklaxem byla splenomegalie (19 cm), lymfadenopatie do 3 cm, WBC 5,8 x 109/l, Hb 122 g/l, PLT 90 x 109/l, bylo terapií venetoklaxem dosaženo velmi dobré parciální remise (splenomegalie 14 cm, trombocytopenie 90 x 109/l).
Lze tedy shrnout, že nyní 68letý pacient je šest let od diagnózy CLL s prognosticky vysoce nepříznivou delecí 17p po více než třech letech cílené léčby bez známek choroby a s velmi dobrou kvalitou života.
Kasuistika 2
Druhý pacient byl rovněž muž (narozený v roce 1947), se středně nepříznivými prognostickými faktory (nemutovaný stav IgVH, delece 13q, masivní lymfadenopatie, splenomegalie) a s významnými komorbiditami: ischemická choroba srdeční, fibrilace síní na antikoagulační léčbě, diabetes mellitus 2. typu, arteriální hypertenze, hypertrofie prostaty, varixy s celkovým CIRS 9, u něhož byla CLL diagnostikována v roce 2008. Od téhož roku byl léčen, v 1. linii 3x R-COP bez odpovědi, ve 2. linii (od září 2008) byl podán 6x cladribin. Pacient byl v parciální remisi šest let, v roce 2014 relaboval (Rai IV, masivní lymfadenopatie, B symptomy), nově se objevila klonální evoluce (delece 17p ve 23 %), komorbidity zůstaly (CIRS 9).
Z úvah o další terapii v roce 2014, kdy ještě nebyly k dispozici cílené léky, byla zvolena i vzhledem ke komorbiditám jako 3. linie léčby varianta 1x FCR lite + 1x rituximab. Pacient ji bohužel zcela netoleroval, objevila se zejména protrahovaná neutropenie. V témže roce proto byla podána ještě jako 4. linie 4x rituximab s dexamethasonem, po níž bylo dosaženo parciální remise, avšak následovala poměrně komplikovaná infekce a léčba musela být ukončena. Už po čtyřech měsících (únor 2015) však došlo k relapsu (Rai II, masivní lymfadenopatie, vysoký nárůst klonu s del17p (84 %).
Pro další terapii (tehdy ještě nebyl k dispozici venetoklax) byla vzhledem ke komorbiditám a antikoagulační léčbě zvolena varianta rituximab + idelalisib (od května 2015). Pacient na léčbu odpovídal, avšak nedosáhl kritérií parciální remise. Po roce léčby (červen 2016) se opět dostavila progrese a následně byla započata terapie venetoklaxem.
Podkladem byly výsledky studie fáze II u pacientů s R/R CLL léčených idelalisibem (n = 36), kde bylo dosaženo ORR 67 % (2x kompletní remise, 1x kompletní remise s nekompletní hematologickou obnovou), medián přežití bez progrese (progression free survival, PFS) nebyl dosažen, odhadovaný PFS ve 12 měsících byl 79 %).
Před léčbou venetoklaxem byly u nemocného zjištěny splenomegalie (22 cm), lymfadenopatie > 5 cm, WBC 12,5 x 109/l, Hb 95 g/l, PLT 115 x 109/l. Venetoklax byl podáván od července 2016, titrace dávky byla vzhledem k jen střednímu riziku nádorového rozpadu provedena ambulantně. Léčbou se podařilo dosáhnout parciální remise na hranici kompletní, k níž pravděpodobně směřuje - splenomegalie (14 cm), lymfadenopatie (18 mm). Jedinou komplikací byla asi po roce (v červenci 2017) sekundární idiopatická trombocytopenická purpura, kterou se podařilo zvládnout.
Můžeme tedy shrnout, že nyní 71letý pacient je deset let od diagnózy a více než dva roky užívá venetoklax bez známek choroby a s velmi dobrou kvalitou života.
ZÁVĚR
Pacienti s CLL s prokázanou delecí krátkého raménka 17. chromosomu nebo mutací genu TP53 mají významně horší prognózu, s vyšším rizikem progrese do symptomatického onemocnění, s horší a kratší odpovědí na chemoimunoterapii. Delece 17p a/anebo mutace TP53 jsou aktuálně nejvýznamnější abnormality, které nezávisle predikují odpověď na léčbu a zároveň ovlivňují volbu
léčebného postupu u CLL. Tradiční chemoimunoterapie nenabízí dlouhodobou kontrolu nemoci a pacienti s delecí 17p byli obvykle zvažováni k provedení alogenní transplantace kostní dřeně. Nové molekuly typu BCRi signalizace nebo antagonistů antiapoptotického proteinu BCL-2 vykazují vynikající aktivitu u všech genetických subtypů CLL, včetně onemocnění s mutací TP53 a delecí 17p, dokonce i u relabujících/refrakterních onemocnění, s vyšším procentem dosažených odpovědí a prodlouženým přežitím bez progrese, a mění tak algoritmy pro léčbu pacientů s mutací TP53 i indikaci k alogenní transplantaci.
Na závěr symposia se diskutovala i současná role alogenních transplantací. Jejich počet sice dnes klesá, avšak nadále jsou jedinou možností vyléčení. Měly by proto být prováděny u mladších pacientů v dobré kondici, zvážit je třeba jejich provedení při opakované progresi, ale neměly by být indikovány u pacientů, kteří dostávají první cílený lék. V současnosti probíhají klinické studie, které mají určit optimální léčebný postup s cílem navodit dlouhodobou remisi onemocnění. Pokud jde o venetoklax, stává se hlavní terapeutickou možností u pacientů, u nichž selhala léčba ibrutinibem nebo idelalisibem, nebo kteří jsou pro inhibitory BCR nevhodní, a i přes některé dosud otevřené otázky se předpokládá, že již v blízké budoucnosti zásadně změní strategii léčby zejména rizikových forem CLL.
Mgr. Jaroslav Hořejší