Tebentafusp v léčbě uveálního melanomu
Celý článek je dostupný pouze pro předplatitele
Staňte se pravidelným odběratelem našeho časopisu Onkologická revue...
ÚVOD
Uveální melanom je nejčastější nádorové onemocnění postihující oko. Ve srovnání s jinými malignitami je ale jeho incidence nízká, v Evropě je udávána kolem 4-7 případů / 1 000 000 obyvatel.1 Podobně jako kožní melanom má i melanom uveální původ v melanocytech. Nicméně mezi nimi existují značné rozdíly, a to již na molekulární úrovni, které jsou podkladem agresivnějšího biologického chování uveálního melanomu a jeho rezistence k léčbě. Oko je tzv. imunitně privilegovaný orgán, který je vcelku dobře chráněný před účinky ultrafialového záření. Uveální melanom vykazuje obecně nižší expresi ligandu programované buněčné smrti 1 (programmed cell death-ligand 1, PD-L1) jak na nádorových buňkách, tak na lymfocytech infiltrujících nádor (5,1 vs. 26,1, p < 0,0001, resp. 51,1 % vs. 73,6 %, p = 0,009).2 Má také jednu z nejnižších mutačních náloží. Výjimečné jsou mutace BRAF, KRAS, CKIT, naopak nalezneme onkogenní nebo „loss-of-function“ mutace driver genů GNAQ, GNA11, EIF1AX, SF3B1, BAP1 a PLCB4.3
 V terapii lokalizovaných stadií uveálního melanomu se uplatňují vizus zachovávající lokální metody (chirurgické, fototerapie, radioterapie), k enukleaci se přistupuje méně. Po chirurgickém výkonu není zatím doporučena žádná adjuvantní terapie. V čase zjištění diagnózy je onemocnění metastazující u cca 3 % pacientů. Uveální melanom se bohu-žel vyznačuje značným rizikem relapsu (20-70 %); metastazuje hematogenně, zejména do jater, ale také do kostí, plic a měkkých tkání. V případě, že je postižení omezeno pouze na játra, lze podle stavu pacienta, rozsahu postižení, ale také podle zkušenosti a možností daného pracoviště uvažovat o lokálních metodách (izolovaná hepatální perfuze, ablace, embolizace, chirurgický výkon, stereotaktická radioterapie). U rozsáhlejšího a/nebo extrahepatálního postižení je jediným možným terapeutickým zásahem systémová léčba.
V terapii lokalizovaných stadií uveálního melanomu se uplatňují vizus zachovávající lokální metody (chirurgické, fototerapie, radioterapie), k enukleaci se přistupuje méně. Po chirurgickém výkonu není zatím doporučena žádná adjuvantní terapie. V čase zjištění diagnózy je onemocnění metastazující u cca 3 % pacientů. Uveální melanom se bohu-žel vyznačuje značným rizikem relapsu (20-70 %); metastazuje hematogenně, zejména do jater, ale také do kostí, plic a měkkých tkání. V případě, že je postižení omezeno pouze na játra, lze podle stavu pacienta, rozsahu postižení, ale také podle zkušenosti a možností daného pracoviště uvažovat o lokálních metodách (izolovaná hepatální perfuze, ablace, embolizace, chirurgický výkon, stereotaktická radioterapie). U rozsáhlejšího a/nebo extrahepatálního postižení je jediným možným terapeutickým zásahem systémová léčba.
SYSTÉMOVÁ LÉČBA UVEÁLNÍHO MELANOMU
Pokud porovnáváme kožní a uveální melanom z hlediska spektra a účinnosti systémové léčby, lze konstatovat, že v léčbě uveálního melanomu nebylo zdaleka dosaženo takových úspěchů a možnosti systémové léčby jsou značně omezené. Dlouho nebyl definován žádný léčebný standard ani pro první linii léčby tohoto onemocnění. Výsledky klinických studií, případně další klinická data bývají negativní nebo přinejmenším sporné. Uveální melanom je onemocněním chemorezistentním. Pro ilustraci uvedeme např. výsledky studie fáze II, kdy režim BOLD (bleomycin, vincristin, lomustin, dacarbazin) spolu s rekombinantním interferonem alfa-2b neprokázal žádnou léčebnou odpověď a stabilizace onemocnění bylo dosaženo pouze u 8 % pacientů.4 Podobně biologická léčba v podobě inhibitorů BRAF/MEK vzhledem k absenci těchto mutací postrádá smysl a molekulární alterace typické pro uveální melanom minimálně prozatím nejsou terapeuticky ovlivnitelné. Pro moderní imunoterapii checkpoint inhibitory není dostatek dat. Je to dáno hlavně tím, že z většiny proběhlých klinických studií byli právě pacienti s uveálním melanomem vyloučeni. Nasazení checkpoint inhibitorů se proto opírá o ne zcela konzistentní data z retrospektivních analýz nebo menších studií. Je zřejmé, že jisté léčebné výsledky přináší a podobně jako u kožního melanomu se zdá být kombinovaná imunoterapie nivolumabem a ipilimumabem nejúčinnějším režimem. Například jednoramenná studie fáze II GEM1402, která byla provedena španělskými autory u 52 pacientů, přinesla na poměry tohoto agresivního onemocnění zajímavé výsledky u nepředléčených pacientů (necelých 80 % mělo jaterní postižení, více než polovina pak extrahepatální postižení); primárním cílem bylo jednoleté celkové přežití – to dosáhlo 51,9 % (95% interval spolehlivosti [confidence interval, CI] 38,3-65,5). Léčebná odpověď byla zaznamenána u 12 %, stabilizace onemocnění bylo dosaženo u zhruba poloviny nemocných, medián času do progrese (progression free survival, PFS) byl 3,0 měsíce a medián celkového přežití (overall survival, OS) byl 12,7 měsíce. Nezanedbatelná byla toxicita - 54 % pacientů mělo toxicitu stupně 3 a vyšší.5 Stejný režim byl použit v jiné studii fáze II amerických autorů u 35 pacientů, kteří mohli být libovolně předléčeni. Primárním cílem byla objektivní léčebná odpověď (objective response rate, ORR), která dosáhla 18 % (1 kompletní odpověď a 5 parciálních odpovědí), medián PFS byl 5,5 měsíce (95% CI 3,4-9,5), přežití po prvním roce bylo 56 % a medián OS dosáhl 19,1 měsíce (95% CI 9,6 - nedosaženo), toxicita stupně 3/4 byla zjištěna u zhruba 40 % pacientů.6 Vzhledem k nedostatku randomizovaných klinických studií, které by vedly k definování standardní systémové terapie uveálního melanomu v první linii, byla ještě donedávna v doporučeních National Comprehensive Cancer Network (NCCN) uváděna jako jediná preferovaná léčebná možnost účast v klinické studii. Nicméně v roce 2021 byly publikovány výsle dky klinické studie fáze III NCT03070392, ve které inovativní lék tebentafusp ze skupiny imunomobilizačních monoklonálních T buněčných receptorů proti nádorovému bujení (immunomobilizing monoclonal T-cell receptor against cancer, ImmTAC) ve srovnání s volbou zkoušejícího lékaře jako první prokázal prodloužení OS, a to u metastazujícího uveálního melanomu vykazujícího HLA-A*02:01 pozitivitu.7
TEBENTAFUSP – LÉK ZE SKUPINY ImmTAC
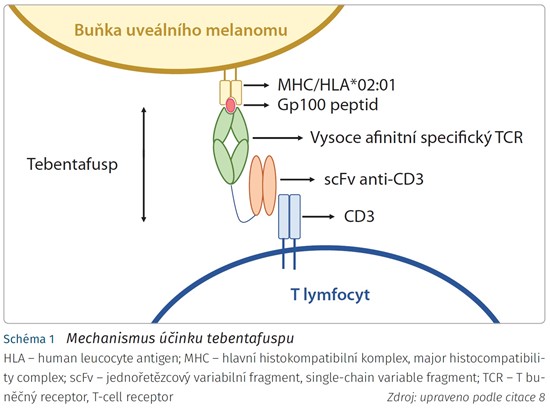
Léky ze skupiny ImmTAC představují nový velmi slibný směr v imunoterapii nádorů, zcela novou léčebnou strategii založenou na přiblížení imunitních efektorových buněk k buňkám nádorovým a následném spuštění imunitní reakce. ImmTAC obecně jsou fúzní proteiny. Základem je modifikovaný vysoce afinitní a specifický T buněčný receptor (T-cell receptor, TCR). Na rozdíl od klasických protilátek jsou ImmTAC schopny rozeznávat fragmenty intracelulárních antigenů prezentovaných na buněčném povrchu cestou HLA (human leucocyte antigen). T buněčný receptor je pak spojený s efektorovou částí molekuly ImmTAC, kterou je humanizovaný j ednořetězcový protilátkový fragment specifický pro CD3 (single-chain variable fragment, scFv). Ten váže polyklonální T lymfocyty exprimující CD3. I při nízké hustotě prezentovaného antigenu dochází k účinnému přesměrování CD3+ buněk k buňkám nádorovým. Tebentafusp (schéma 1) je tzv. „first-in-class“ molekula této lékové skupiny. Její vysokoafinitní TCR se váže s tumor asociovaným antigenem gp100, resp. jeho fragmentem YLEPGPVTA prezentovaným v komplexu s HLA-A*02:01.9 Komplex HLA-A*02:01 je přítomný u 40 až 50 % kavkazské populace.10 Tebentafusp byl v lednu 2022 schválen Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) k léčbě HLA-A*02:01 pozitivního neresekovatelného nebo metastazujícího uveálního melanomu u dospělých pacientů.
Od 1. 4. 2022 je v této indikaci schválen i Evropskou lékovou agenturou.
TEBENTAFUSP – KLINICKÉ STUDIE FÁZE I A II
Schválení tebentafuspu regulačními autoritami předcházelo několik klinických studií. IMCgp100-101 (NCT01211262) byla studie fáze I (first-in-human) a vedla ke stanovení maximální tolerované dávky. Zahrnovala jak pacienty s kožním, tak uveálním melanomem (celkem 84 pacientů, 19 pacientů s uveálním melanomem). Celkové přežití po prvním roce bylo v obou kohortách shodně 65 %. Z hodnotitelných 15 pacientů s uveálním melanomem dosáhli 3 (20 %) částečné odpovědi a 7 (47 %) stabilizace onemocnění. Dalším posunem pak byla studie fáze I/II IMCgp100-102 (NCT02570308). Její fáze I eskalovala dávku tebentafuspu, s cílem dosažení vyšší účinnosti při dobré toleranci. Dávka doporučená pro fázi II byla nakonec o 36 % vyšší než maximální tolerovaná dávka v první uvedené studii.11 Fáze II hodnotila 127 předléčených pacientů (z nich 105 systémovou léčbou, 52 monoterapií – přípravky zaměřenými proti proteinu programované buněčné smrti 1 (programmed cell death receptor 1, PD-1) / PD-L1, 30 kombinovanou anti-PD1/anti-PD-L1 léčbou) a většina (58 %) měla zvýšenou počáteční koncentraci laktátdehydrogenázy. Jaterní postižení (samostatné nebo v kombinaci s extrahepatálním postižením) bylo u 97 % pacientů. Aplikována byla zahajovací dávka 20 µg (cyklus 1 den 1, C1D1), 30 µg C1D8 a pak doporučená dávka pro fázi II - 68 µg C1D15, následovala léčba týdně ve čtyřtýdenních cyklech. Primárním cílem této studie byl odhad objektivní léčebné odpovědi (na základě kritérií RECIST v1.1), sekundárním bezpečnost, celkové přežití, přežití bez progrese a míra kontroly onemocnění. Míra léčebné odpovědi nebyla vysoká – dosáhla 5 % (95% CI 2-10). Míra kontroly nemoci (disease control rate, DCR) v týdnu > 16 byla 32 % (n = 40; 95% CI 24-40). Jednoleté OS bylo 62 % (95% CI 53-70), medián OS dosáhl 16,8 měsíce (95% CI 12,9-21,3). Exploratorní analýza prokázala, že časná redukce cirkulující nádorové DNA je silně asociována s OS, a to dokonce i u pacientů, u kterých byla zaznamenána radiologická progrese. U každého pacienta byl zaznamenán alespoň jeden projev toxicity, nejčastěji vyrážka (87 %), horečka (80 %) a svědění (67 %); většinou šlo o mírné až střední projevy, u kterých po počátečních dávkách došlo ke snížení jak četnosti, tak i intenzity.12
TEBENTAFUSP – KLINICKÁ STUDIE FÁZE III
IMCgp 100-202 (NCT03070392) byla randomizovaná otevřená multicentrická studie. Nábor do ní probíhal od března 2017 do června 2020. Zařazených bylo 378 nepředléčených pacientů s metastazujícím uveálním melanomem, kteří vykazovali genotyp HLA-A*02:01. Šlo o pacienty starší 18 let v dobrém celkovém stavu - s výkonnostním stavem podle Eastern Cooperative Oncology Group (Eastern Cooperative Oncology Group performance status, ECOG PS) 0-1. Kromě vyloučení systémově předléčených pacientů nebyli zařazováni ani pacienti s jaterním postižením po lokálních terapeutických výkonech, dále pacienti se symptomatickými neléčenými metastázami mozku a pacienti s klinicky významným kardiálním onemocněním, pacienti s intersticiální plicní nemocí ani pacienti s aktivním autoimunitním onemocněním vyžadujícím léčbu glukokortikoidy nebo systémovou imunosupresivní léčbu. Naopak byla povolena léčba neoadjuvantní nebo adjuvantní. Tebentafusp byl v poměru 2 : 1 (252 pacientů vs. 126 pacientů) srovnáván s volbou zkoušejícího lékaře, přičemž většinou (82 %) byl podáván pembrolizumab, další přípravky byly ipilimumab (13 %) nebo dacarbazin (6 %), žádný pacient nebyl léčen kombinovanou imunoterapií anti-PD-1 / inhibitorem cytotoxického antigenu 4 asociovaného s T lymfocyty (anti-cytotoxic T-lymphocyte associated antigen 4, anti-CTLA-4). Dávkování tebentafuspu bylo stejné jako ve studii fáze II, tj. 20 µg C1D1, 30 µg C1D8, 68 µg C1D15, dávkou 68 µg se pokračovalo v týdenních intervalech. U tebentafuspu, pembrolizumabu a ipilimumabu bylo možné za definovaných podmínek pokračovat i po radiologicky stanovené progresi onemocnění. Cross-over vstupně nebyl povolen. Medián sledování byl 14,2 měsíce.7
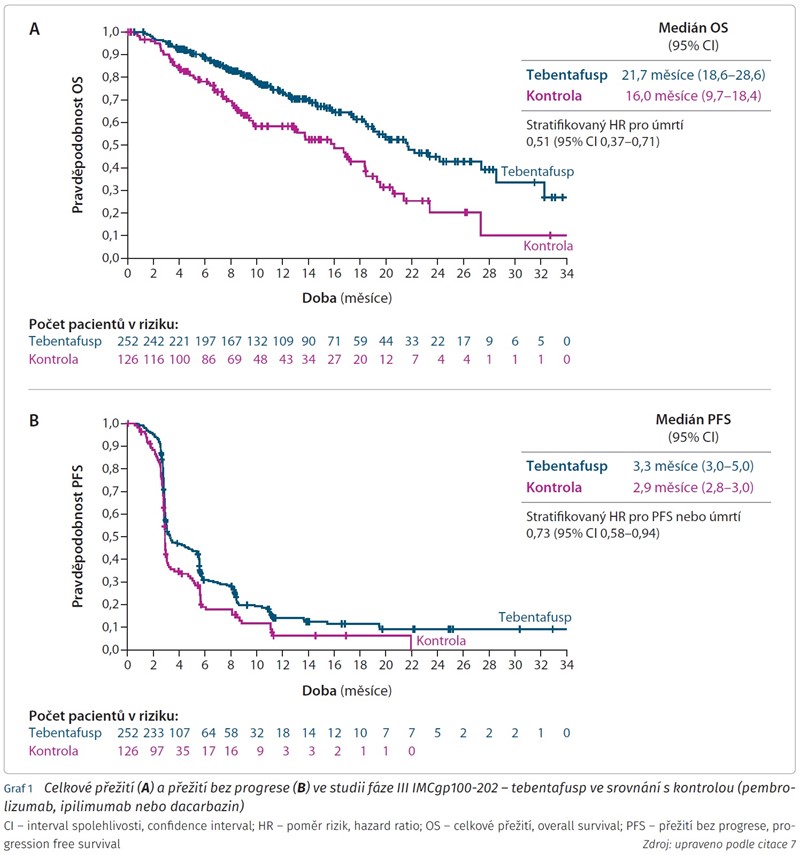
Primárním cílem bylo OS. Medián OS v populaci s léčebným záměrem (intention-to-treat, ITT) byl u tebentafuspu 21,7 měsíce (95% CI 18,6-28,6) vs. 16,0 měsíce (95% CI 9,7-18,4), stratifikovaný poměr rizik (hazard ratio, HR) pro úmrtí pak byl 0,51 (95% CI 0,37-0,71; p < 0,0001) a studie tímto svůj primární cíl splnila (graf 1A). Odhadované přežití po prvním roce v ITT populaci dosáhlo 73 % (95% CI 66-79) ve skupině s tebentafuspem vs. 59 % (95% CI 48-67) v kontrolní skupině. Vliv na zlepšení přežití byl pozorován ve všech předem specifikovaných podskupinách. Tento výsledek byl v léčbě metastazujícího uveálního melanomu naprosto průlomový.
Co se sekundárních cílů týče, odhadované PFS v 6 měsících v ITT populaci dosáhlo u tebentafuspu 31 %, u kontroly pak 19 % (stratifikovaný HR pro progresi nebo úmrtí 0,73; 95% CI 0,58-0,94; p = 0,01) (graf 1B). Podobně jako v předchozí studii bylo dosaženo léčebné odpovědi u tebentafuspu pouze v 9 % (95 % CI 6-13), u kontroly 5 % (95% CI 2-10). Kontroly onemocnění (tj. kompletní odpověď, parciální odpověď nebo stabilizace onemocnění ≥ 12 týdnů) bylo dosaženo u 46 % pacientů léčených tebentafuspem (95% CI 39-52), u kontrolní skupiny pak 27 % (95% CI 20-36). Medián trvání odpovědi byl podobný, 9,9 měsíce vs. 9,7 měsíce. Zajímavé bylo zjištění v rámci „landmark“ analýzy (kontrola léčebné odpovědi po určitých časových intervalech), kdy tebentafusp u pacientů, jejichž nejlepší odpověď před dnem 100 byla progrese, rovněž vedl k prodloužení přežití – medián OS byl 15,3 měsíce (95% CI 12,0 - nedosaženo) ve srovnání s 6,5 měsíce u kontroly (95% CI 4,9-13,4), HR pro úmrtí byl 0,43 (95% CI 0,27-0,68). V předem specifikované analýze zaměřené na prognostický vliv vyrážky, která se objevila v prvním týdnu, bylo sice zjištěno lepší přežívání, ale přítomnost vyrážky v mnohorozměrné Cox analýze nebyla prokázána jako nezávislý prediktor benefitu OS.7
POSTAVENÍ TEBENTAFUSPU V LÉČBĚ UVEÁLNÍHO MELANOMU
V nejnovějších doporučeních NCCN pro systémovou léčbu metastazujícího uveálního melanomu je nyní tebentafusp u HLA-A*02:01 pozitivních pacientů preferovanou možností. Vzhledem k nízké četnosti léčebných odpovědí je v individuálních případech (např. při velkém rozsahu onemocnění) a při negativitě HLA-A*02:01 ke zvážení nasazení jiné léčby, např. kombinované imunoterapie.13
Přímé srovnání tebentafuspu a kombinované imunoterapie nivolumab + ipilimumab nebylo provedeno. Nepřímé srovnání klinických výstupů, jako je např. jednoleté přežívání, favorizuje tebentafusp – kombinovanou imunoterapií dosažené jednoleté přežití zhruba odpovídá hodnotám v kontrolním rameni studie IMCgp100-202. Také bylo publikováno srovnání dat ze studií GEM-1402 a IMCgp 100-202, kdy po statistické adjustaci proměnných nebyl prokázán signifikantní rozdíl v parametru OS mezi pembrolizumab em a kombinací nivolumab + ipilimumab (HR 0,74; 95% CI 0,45-1,21). Tebentafusp byl ve srovnání s kombinovanou imunoterapií superiorní (HR 0,51; 95% CI 0,32-0,79).14
Toxicita tebentafuspu
Toxicita tebentafuspu není zanedbatelná a má několik specifik. Uvedeme údaje získané ve studii fáze III IMCgp100-202. Toxicita byla hodnocená podle National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) v4.3, syndrom z uvolňování cytokinů podle kritérií American Society for Transplantation and Cellular Therapy (ASTCT) z roku 2019 (viz níže) (tab. 1).
 U závažné toxicity (stupeň 3 nebo 4) byl zaznamenán výrazný rozdíl - u tebentafuspu 44 % a v kontrolním rameni studie 17 %. Ani v jednom případě nedošlo k úmrtí v souvislosti s léčbou. U 57 % pacientů, kteří byli léčeni tebentafuspem, se nežádoucí události spojené s léčbou objevily v průběhu prvních čtyř týdnů, kdy docházelo k eskalaci dávky, při opakující se dávce pak klesá jak četnost, tak závažnost nežádoucích účinků. Kvůli nežádoucím účinkům ukončilo studiovou léčbu tebentafuspem 2 % pacientů, v kontrolním rameni 5 % pacientů. Setkáváme se s dvěma hlavními typy toxicity – toxicita v souvislosti s cytokiny a kožní toxicita. V první skupině dominovaly febrilie (76 %), zimnice (47 %) a hypotenze (38 %), ve skupině druhé zase vyrážka (83 %), pruritus (69 %) a erytém (23 %). Syndrom z uvolňování cytokinů (cytokine release syndrome, CRS), definovaný podle kritérií ASTCT15 na základě přítomnosti febrilií, hypotenze a hypoxie (tab. 2), se ve studii fáze III vyskytl u 89 % pacientů léčených tebentafuspem. Častější byl během několika hodin po aplikaci prvních třech dávek. Stupeň 1 byl dokumentován u 12 %, stupeň 2 u 76 %, stupeň 3 u 1 % pacientů. Syndrom z uvolňování cytokinů stupně 4 nebo 5 zaznamenán nebyl.7 Kromě již zmíněných příznaků se objevuje hypoxie, zvracení, bolesti hlavy a únava. U CRS stupně 1 a 2 lze v léčbě pokračovat. V případě stupně 3 je doporučeno podávání tebentafuspu přerušit, u stupně 4 pak trvale vysadit. Co se týče léčebných doporučení, odkazujeme na aktuálně platný souhrn údajů o přípravku (summary of product characteristics, SPC).16 V případě kožní toxicity byly nejčastějšími projevy (jakéhokoli stupně) vyrážka (83 %), pruritus (69 %) a erytém (23 %).7 Již od 2. stupně (podle NCI CTCAE v4.03.) je doporučeno tebentafusp přerušit, u 4. stupně pak trvale vysadit.16 Stran dalších nežádoucích účinků je potenciálně závažná toxicita kardiální - byly pozorovány srdeční příhody (tachykardie, arytmie, prodloužení QT intervalu), proto je nutné zvláště u potenciálně predisponovaných pacientů během prvních tří týdnů léčby a následně podle zdravotního stavu vyhotovit EKG před a po aplikaci tebentafuspu.16
U závažné toxicity (stupeň 3 nebo 4) byl zaznamenán výrazný rozdíl - u tebentafuspu 44 % a v kontrolním rameni studie 17 %. Ani v jednom případě nedošlo k úmrtí v souvislosti s léčbou. U 57 % pacientů, kteří byli léčeni tebentafuspem, se nežádoucí události spojené s léčbou objevily v průběhu prvních čtyř týdnů, kdy docházelo k eskalaci dávky, při opakující se dávce pak klesá jak četnost, tak závažnost nežádoucích účinků. Kvůli nežádoucím účinkům ukončilo studiovou léčbu tebentafuspem 2 % pacientů, v kontrolním rameni 5 % pacientů. Setkáváme se s dvěma hlavními typy toxicity – toxicita v souvislosti s cytokiny a kožní toxicita. V první skupině dominovaly febrilie (76 %), zimnice (47 %) a hypotenze (38 %), ve skupině druhé zase vyrážka (83 %), pruritus (69 %) a erytém (23 %). Syndrom z uvolňování cytokinů (cytokine release syndrome, CRS), definovaný podle kritérií ASTCT15 na základě přítomnosti febrilií, hypotenze a hypoxie (tab. 2), se ve studii fáze III vyskytl u 89 % pacientů léčených tebentafuspem. Častější byl během několika hodin po aplikaci prvních třech dávek. Stupeň 1 byl dokumentován u 12 %, stupeň 2 u 76 %, stupeň 3 u 1 % pacientů. Syndrom z uvolňování cytokinů stupně 4 nebo 5 zaznamenán nebyl.7 Kromě již zmíněných příznaků se objevuje hypoxie, zvracení, bolesti hlavy a únava. U CRS stupně 1 a 2 lze v léčbě pokračovat. V případě stupně 3 je doporučeno podávání tebentafuspu přerušit, u stupně 4 pak trvale vysadit. Co se týče léčebných doporučení, odkazujeme na aktuálně platný souhrn údajů o přípravku (summary of product characteristics, SPC).16 V případě kožní toxicity byly nejčastějšími projevy (jakéhokoli stupně) vyrážka (83 %), pruritus (69 %) a erytém (23 %).7 Již od 2. stupně (podle NCI CTCAE v4.03.) je doporučeno tebentafusp přerušit, u 4. stupně pak trvale vysadit.16 Stran dalších nežádoucích účinků je potenciálně závažná toxicita kardiální - byly pozorovány srdeční příhody (tachykardie, arytmie, prodloužení QT intervalu), proto je nutné zvláště u potenciálně predisponovaných pacientů během prvních tří týdnů léčby a následně podle zdravotního stavu vyhotovit EKG před a po aplikaci tebentafuspu.16
Specifické podání tebentafuspu
První tři dávky tebentafuspu jsou eskalované. Aplikace nitrožilní infuze trvá 15-20 minut. Začíná se dnem 1 v dávce 20 µg, v den 8 v dávce 30 µg, v den 15 je podávána dávka 68 µg, ve které se pak pokračuje v týdenních intervalech po dobu klinického přínosu, případně do nepřijatelné toxicity. Riziko vzniku syndromu z uvolnění cytokinů je důvodem, proč se nejméně první tři podání doporučují za hospitalizace s nutností monitorování po dobu minimálně 16 hodin po aplikaci. V rámci premedikace je nutné intravenózní podání tekutin jako prevence hypotenze. Při uspokojivé toleranci prvních tří dávek je možné pokračovat v ambulantním režimu s observací.16
ZÁVĚR
Metastazující uveální melanom je velmi agresivní onemocnění s nepříznivou prognózou. Dlouho nebyla definována standardní terapie pro první linii, podle omezených dat byla nejúčinnější léčbou kombinace nivolumab + ipilimumab, kdy jednoleté celkové přežití dosáhlo 51,9 %5 a 56 %.6 Od loňského roku jsou léčebné možnosti u neresekovatelného nebo metastazujícího HLA-A*02:01 pozitivního uveálního melanomu rozšířené o inovativní lék tebentafusp, který je prvním zástupcem lékové skupiny ImmTAC. Také jako první prokázal prodloužení celkového přežití ve studii fáze III, a to ve srovnání s volbou investigátora, tj. s monoterapií pembrolizumabem, ipilimumabem nebo dacarbazinem.
Tebentafusp jako zástupce nové formy imunoterapie přináší také nové spektrum toxicity, které je dáno inovativním mechanismem působení. Nejčastějším, potenciálně velmi závažným a v onkologii solidních nádorů doposud málo vídaným nežádoucím účinkem je syndrom z uvolňování cytokinů.
Výrazné a signifikantní prodloužení celkového přežití pacientů léčených tebentafuspem je v kontrastu s nízkou četností léčebných odpovědí. Tento jev, i když ne v takovém rozsahu, je již obecně u imunoterapie známý.17 Ukazuje se také, že při pokračování v léčbě navzdory progresi onemocnění podle standardních kritérií RECIST může mít pacient prospěch. Otevírá rovněž možnost využití cirkulující nádorové DNA jako náhradního prognostického parametru.
Na definitivní odpověď na otázku, jaká případná sekvence imunoterapie (monoterapie nebo kombinované terapie) je vhodná, budeme muset počkat; první výsledky byly prezentovány např. na kongresu European Society for Medical Oncology 2022, šlo ale o malé skupiny pacientů.18 Tebentafusp si hledá své místo i v léčbě kožního melanomu, na základě nedávno publikovaných aktualizovaných slibných výsledků celkového přežití u pacientů s metastazujícím kožním melanomem, kteří relabovali nebo byli refrakterní na předchozí léčbu anti-PD-1. Pacienti léčení tebentafuspem a anti-PD-L1 dosáhli ročního přežití zhruba 75 %, přičemž obvyklé ročné přežití v této skupině pacientů se pohybuje kolem 55 %.19
LITERATURA
- Mallone S, De Vries E, Guzzo M, et al. Descriptive epidemiology of malignant mucosal and uveal melanomas and adnexal skin carcinomas in Europe. Eur J Cancer 2012;48:1167-1175.
- Javed A, Arguello D, Johnston C, et al. PD-L1 expression in tumor metastasis is different between uveal melanoma and cutaneous melanoma. Immunotherapy 2017;9:1323-1330.
- Johansson P, Aoude LG, Wadt K, et al. Deep sequencing of uveal melanoma identifies a recurrent mutation in PLCB4. Oncotarget 2016;7:4624-4631.
- Kivela T, Suciu S, Hansson J, et al. Bleomycin, vincristine, lomustine and dacarbazine (BOLD) in combination with recombinant interferon alpha-2b for metastatic uveal melanoma. Eur J Cancer 2003;39:1115-1120.
- Piulats JM, Espinosa E, de la Cruz Merino L, et al. Nivolumab plus ipilimumab for treatment-naïve metastatic uveal melanoma: an open-label, multicenter, phase II trial by the Spanish Multidisciplinary Melanoma Group (GEM-1402). J Clin Oncol 2021;39:586-598.
- Pelster MS, Gruschkus SK, Bassett R, et al. Nivolumab and ipilimumab in metastatic uveal melanoma: results from a single-arm phase II study. J Clin Oncol 2021;39:599-607.
- Nathan P, Hassel JC, Rutkowski P, et al. Overall survival benefit with tebentafusp in metastatic uveal melanoma. N Engl J Med 2021;385:1196-1206.
- Howlett S, Carter TJ, Shaw HM, Nathan PD. Tebentafusp: A in-class treatment for metastatic uveal melanoma. Ther Adv Med Oncol 2023;15:17588359231160140.
- Liddy N, Bossi G, Adams KJ, et al. Monoclonal TCR-redirected tumor cell killing. Nat Med 2012;18:980-987.
- Damato BE, Dukes J, Goodall H, Carvajal RD. Tebentafusp: T cell redirection for the treatment of metastatic uveal melanoma. Cancers (Basel) 2019;11:971.
- Carvajal RD, Nathan P, Sacco JJ, et al. Phase I study of safety, tolerability, and efficacy of tebentafusp using a step-up dosing regimen and expansion in patients with metastatic uveal melanoma. J Clin Oncol 2022;40:1939-1948.
- Carvajal RD, Butler MO, Shoushtari AN, et al. Clinical and molecular response to tebentafusp in previously treated patients with metastatic uveal melanoma: a phase 2 trial. Nat Med 2022;28:2364-2373.
- National Comprehensive Cancer Network. NCCN Guidelines (cit. 2. 2023) [online]. Dostupné na: https://www.nccn.org/guidelines/guidelines-detail
- Rodriguez JMP, Piperno-Neumann S, Rutkowski P, et al. 823P A propensity score weighted comparison of tebentafusp or pembrolizumab versus combination ipilimumab and nivolumab in untreated metastatic uveal melanoma. Ann Oncol 2022;33:S924.
- Lee DW, Santomasso BD, Locke FL, et al. ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Transplant 2019;25:625-638.
- SÚKL. Souhrn údajů o přípravku Kimmtrak (cit. 21. 2. 2023) [online]. Dostupné na: https://www.sukl.cz/leciva/em-tebentafusp
- Hodi FS, Hwu WJ, Kefford R, et al. Evaluation of immune-related response criteria and RECIST v1.1 in patients with advanced melanoma treated with pembrolizumab. J Clin Oncol 2016;34:1510-1517.
- Dimitriou F, Hassel JC, Orloff M, et al. 832P Treatment sequence with tebentafusp (tebe) and anti-PD1/ipilimumab (PD1+IPI) in HLA-A2*02:01 patients (pts) with metastatic uveal melanoma (mUM). Ann Oncol 2022;33:S929.
- Middleton MR, Hamid O, Shoushtari AN, et al. Updated overall survival (OS) data from the phase 1b study of tebentafusp (tebe) as monotherapy or combination therapy with durvalumab (durva) and/or tremelimumab (treme) in metastatic cutaneous melanoma (mCM). J Clin Oncol 2022;40(Suppl):104-104.