Pacientka s nemalobuněčným karcinomem plic léčená osimertinibem - kazuistika
06/2020
MUDr. Leona Koubková
Pneumologická klinika 2. LF UK a FN v Motole, Praha
SOUHRN
Dnes již víme, že nemalobuněčný karcinom plic (NSCLC) je geneticky nehomogenní skupinou nádorů. Průkaz genetických aberací nám pak umožňuje predikovat účinnost cílené léčby. Řadu let jsou již vyšetřovány mutace genu pro receptor epidermálního růstového faktoru (EGFR). K dispozici máme tři generace inhibitorů tyrosinkinázy EGFR. Osimertinib je tyrosinkinázový inhibitor EGFR 3. generace, který byl nejprve schválen k léčbě pacientů s lokálně pokročilým nebo metastazujícím NSCLC s prokázanou mutací T790M EGFR (FDA 11/2015 a EMA 2/2016). V současné době je osimertinib schválen i pro léčbu první linie u pacientů s prokázanou aktivační mutací genu EGFR (FDA 4/2018 a EMA 6/2018).
Klíčová slova
nemalobuněčný karcinom plic, mutace genu receptoru epidermálního růstového faktoru, osimertinib
SUMMARY
We know that non-small cell lung cancer (NSCLC) is a genetically inhomogeneous group of tumors. Demonstration of genetic aberrations then allows us to predict the effectiveness of targeted treatment. Mutations in the epidermal growth factor receptor (EGFR) gene have been investigated for many years. We already have three generations of EGFR tyrosine kinase inhibitors available. Osimertinib is a third-generation EGFR tyrosine kinase inhibitor that was first approved for the treatment of patients with locally advanced or metastatic NSCLC with a proven T790M EGFR mutation (FDA 11/2015 and EMA 2/2016). Osimertinib is also currently approved for first-line treatment in patients with a proven activating mutation in the EGFR gene (FDA 4/2018 and EMA 6/18).
Key words
non-small cell lung cancer, epidermal growth factor receptor gene mutation, osimertinib
ÚVOD
Řada studií a klinická praxe potvrdily prediktivní úlohu aktivačních mutací v exonu 18 až 21 genu pro receptor epidermálního růstového faktoru (epidermal growth factor receptor, EGFR). V asijské populaci je EGFR mutace přítomna asi u 40 % a v kavkazské asi u 10-15 % pacientů s nemalobuněčným karcinomem plic (non-small cell lung cancer, NSCLC), především s adenokarcinomem. Nejlepší léčebné výsledky jsou dosahovány u nejčastěji se vyskytujících mutací - s delecí v exonu 19, o něco horší pak u mutace L858R exonu 21. V současné době máme již k dispozici tři generace tyrosinkinázových inhibitorů (tyrosine kinase inhibitor, TKI) EGFR (EGFR TKI) - reverzibilní EGFR TKI 1. generace - erlotinib a gefitinib, ireverzibilní EGFR TKI 2. generace - afatinib a dacomitinib a EGFR TKI 3. generace - osimertinib.
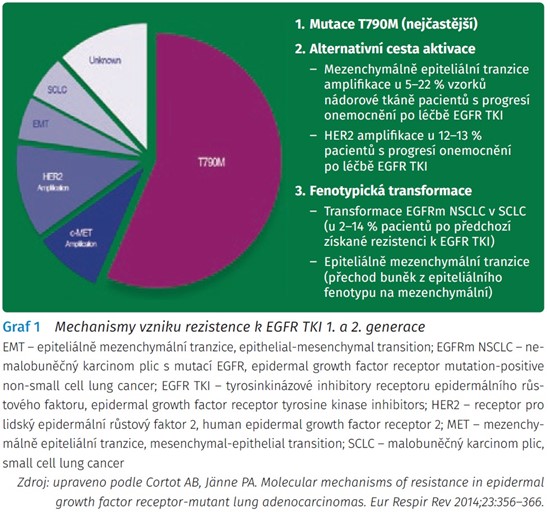 Při léčbě EGFR TKI však musíme počítat se vznikem získané rezistence. Průměrná doba do jejího vzniku při léčbě EGFR TKI nižší generace se udává 12 měsíců. Mechanismy jejího vzniku jsou různé, nejčastěji (až v 60 %) se jedná o mutaci T790M v exonu 20, další jsou pak např. MET amplifikace, HER2 amplifikace či fenotypická transformace v malobuněčný karcinom či přechod buněk z epiteliálního fenotypu na mezenchymální (graf 1). Jsou proto vyvíjeny EGFR TKI vyšších generací zaměřené na rezistentní mutace včetně T790M.
Při léčbě EGFR TKI však musíme počítat se vznikem získané rezistence. Průměrná doba do jejího vzniku při léčbě EGFR TKI nižší generace se udává 12 měsíců. Mechanismy jejího vzniku jsou různé, nejčastěji (až v 60 %) se jedná o mutaci T790M v exonu 20, další jsou pak např. MET amplifikace, HER2 amplifikace či fenotypická transformace v malobuněčný karcinom či přechod buněk z epiteliálního fenotypu na mezenchymální (graf 1). Jsou proto vyvíjeny EGFR TKI vyšších generací zaměřené na rezistentní mutace včetně T790M.
Mutace EGFR jsou v České republice testovány reflexně u adenokarcinomů či blíže nespecifikovaných NSCLC, na žádost klinika pak například u skvamózních karcinomů u nekuřáků. Využití tekutých biopsií, které umožňují vyšetření cirkulující nádorové DNA (circulating tumor, ctDNA) z plazmy, je vhodné zvláště v případech, kdy nádorová tkáň není dostupná a chceme např. vyšetřit přítomnost rezistentní mutace T790M. Senzitivita tohoto vyšetření je ale nižší než při vyšetření bioptované tkáně.
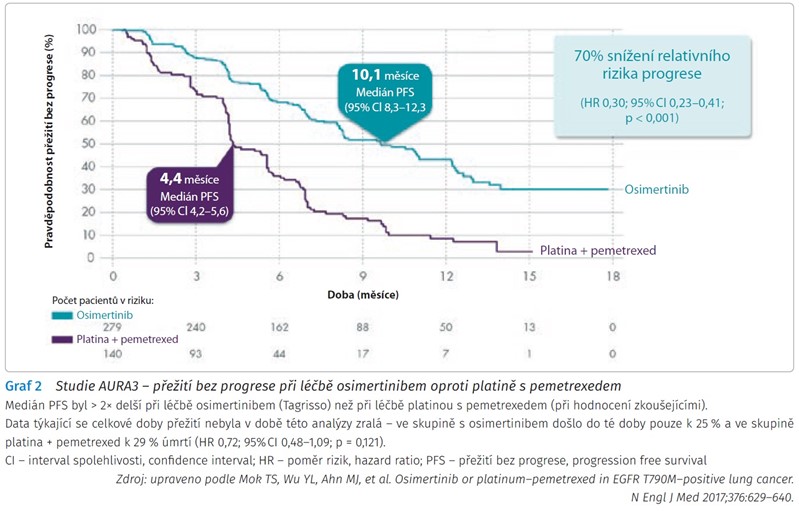
Osimertinib (Tagrisso) je selektivní ireverzibilní inhibitor tyrosinkinázy EGFR 3. generace, který prokázal účinnost u pacientů s NSCLC s aktivačními mutacemi a mutací T790M, jež je rezistentní k léčbě EGFR TKI 1. a 2. generace. Při průkazu rezistentní mutace T790M při selhání léčby EGFR TKI 1. a 2. generace byl osimertinib schválen Food and Drug Administration a European Medicines Agency na základě výsledků studií AURA již v roce 2015 a 2016 (graf 2).
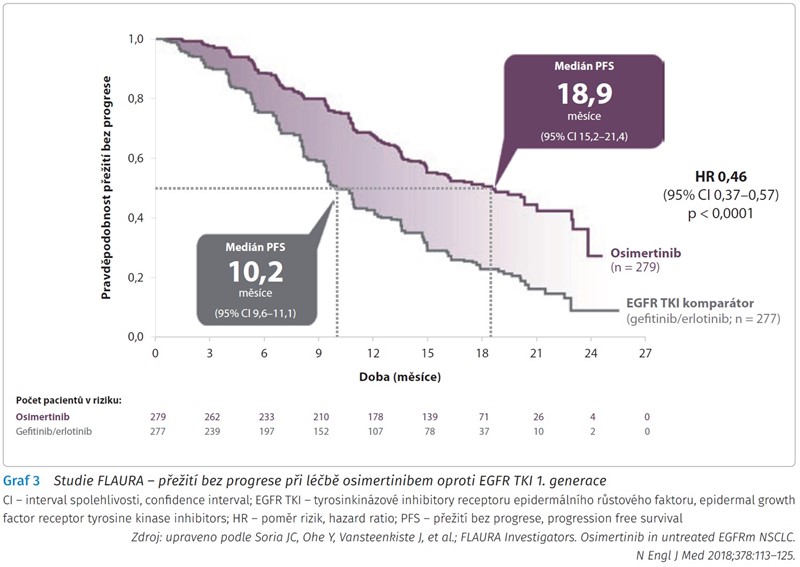
Do 1. linie léčby byl osimertinib schválen v Evropské unii již v červnu 2018 na základě studie fáze III FLAURA, ve které byl porovnáván s EGFR TKI 1. generace gefitinibem či erlotinibem v 1. linii léčby u pacientů s aktivační EGFR mutací v exonu 19 nebo 21. Doba přežití bez progrese byla v rameni s osimertinibem oproti rameni s EGFR TKI 1. generace 18,9 vs. 10,2 měsíce (HR 0,46; 95% CI 0,37-0,57; p < 0,001) (graf 3).
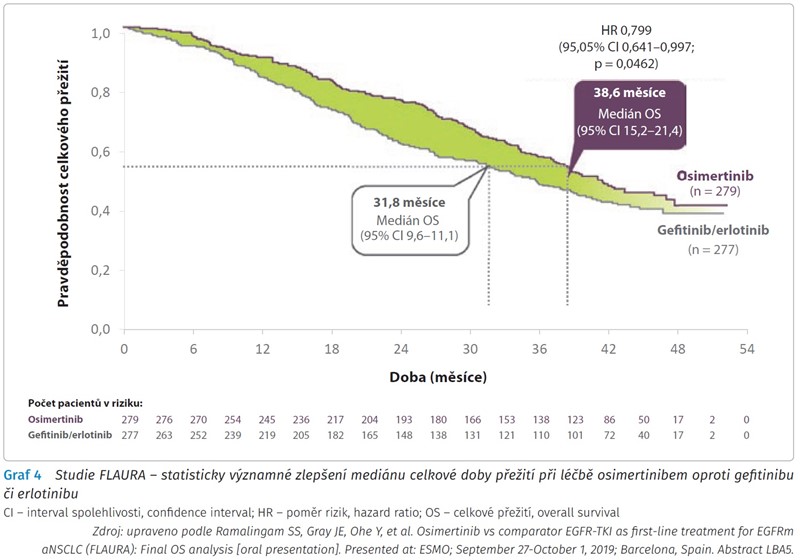
Do studie mohli být zařazeni i pacienti se stabilizovanými metastázami do centrální nervové soustavy (CNS). Také u této podskupiny pacientů vykázal osimertinib oproti EGFR TKI 1. generace přínos z hlediska PFS: 15,2 vs. 9,6 měsíce (HR 0,47; 95% Cl 0,30-0,74; p < 0,001). Při léčbě osimertinibem bylo jak méně progresí v CNS - osimertinib v léčbě 1. linie snížil riziko progrese do CNS o 52 % (HR 0,48; 95% CI 0,26-0,86; p = 0,014), tak i méně nově se objevujících CNS lézí; odpovědi v CNS byly setrvalé, ve srovnání s pacienty ze skupiny EGFR TKI komparátoru. Při progresi onemocnění a prokázané mutaci T790M mohli pacienti ze skupiny EGFR TKI komparátoru přejít na léčbu osimertinibem. Medián celkového přežití (overall survival, OS) publikovaný na konferenci ESMO 2019 byl 38,6 měsíce (95% CI 34,5-41,8) v rameni s osimertinibem a 31,8 měsíce (95% CI 26,6-36,0) ve srovnávacím rameni, HR 0,799 (95% CI 0,641-0,997; p = 0,0462). Jedná se tak o jedinou léčbu EGFR TKI v 1. linii léčby NSCLC, kdy medián celkového přežití přesahuje tři roky (graf 4).
Pochopení mechanismů vzniku rezistence na osimertinib v 1. linii léčby a stanovení následné vhodné léčby je předmětem dalšího výzkumu. Předběžná data ukazují, že mechanismy vzniku rezistence jsou podobné těm, které jsou pozorovány při terapii ve 2. linii léčby při prokázané rezistentní mutaci T790M, například MET amplifikace, získaná mutace C797S a další. Probíhají proto již studie časné fáze zaměřené na překonání rezistence.
POPIS PŘÍPADU
V době diagnózy 70letá pacientka, nekuřačka, bez závažnějších komorbidit, byla odeslána na naši kliniku ze spádové ambulance tuberkulózy a respiračních nemocí. Od září 2017 udávala bolesti v zádech. Docházela na rehabilitaci, pro přetrvávající potíže byl proveden RTG plic a následně vyšetření výpočetní tomografií (computed tomography, CT) hrudníku, kde byl popsán suspektní primární tumor levé plíce s fluidothoraxem. Na našem pracovišti byl v lednu 2018 diagnostikován bronchogenní karcinom levého horního plicního laloku s mediastinální a nadbrániční lymfadenopatií, se suspektní metastázou v sakru a pravé ilické kosti podle kombinovaného vyšetření pozitronovou emisní tomografií (positron emission tomography, PET) s CT (PET/CT), imunohistochemicky z endobronchiální ultrasonografie (EBUS) lymfatických uzlin skupiny 4 prokázán nemalobuněčný karcinom, nejspíše adenokarcinom. Pro pleurální výpotek v levé plíci byla opakovaně provedena hrudní punkce. Při vyšetření výpotku byly rovněž zastiženy maligní buňky charakteru adenokarcinomu. Jednalo se tedy o metastazující onemocnění stadia IV. Při molekulárně genetickém vyšetření byla prokázána aktivační mutace L858R v exonu 21 genu pro EGFR. Proto byla 2. 2. 2018 zahájena cílená léčba gefitinibem (Iressa).
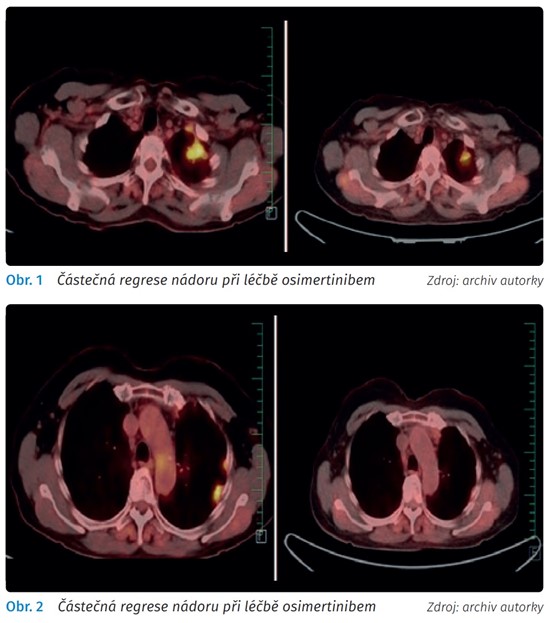 Na vyšetření PET/CT v květnu 2018 se prokázala progrese lymfadenopatie, ale regrese velikosti ložiska levé plíce, regredující fluidothorax vlevo, bez patologického metabolismu glukózy ve skeletu. Na dalším PET/CT v srpnu 2018 došlo k částečné regresi generalizované viabilní neoplazie ve všech minule popsaných ložiscích. Tato regrese trvala až do 28.1.2020, kdy na PET/CT byla popsána progrese ložiska v apexu levé plíce, nodulů v horním laloku subpleurálně, progredující uzliny v mediastinu vlevo aortopulmonálně. Ve snaze o prokázání rezistentní mutace T790M jsme provedli odběr k vyšetření tekuté biopsie, žádná mutace však prokázána nebyla. Proto byla 24. 2. 2020 indikována transtorakální biopsie pod CT kontrolou; histologie opět potvrdila nízce diferencovaný solidně a acinárně rostoucí adenokarcinom a přítomnost aktivační mutace v L858R v exonu 21 genu pro EGFR a nově sekundární rezistentní mutaci T790M v exonu 20 genu pro EGFR. Za zmínku jistě stojí, že v den provedení transtorakální biopsie byl rovněž proveden odběr k vyšetření tekuté biopsie, která byla opět bez průkazů mutací. Léčba gefitinibem byla ukončena a 9. 3. 2020 byla zahájena léčba osimertinibem (Tagrisso). Na kontrolním PET/CT 10. 6. 2020 byla patrná rozměrová a výrazná parciální metabolická regrese vícečetných ložisek v levé plíci a levostranných mediastinálních uzlin (obr. 1 a 2). Kontrolní PET/CT v září 2020 bylo hodnoceno jako stabilizace nemoci. Pacientka při velmi dobré kvalitě života v léčbě pokračuje, z nežádoucích účinků udává pouze občas řidší stolici bez nutnosti léčby.
Na vyšetření PET/CT v květnu 2018 se prokázala progrese lymfadenopatie, ale regrese velikosti ložiska levé plíce, regredující fluidothorax vlevo, bez patologického metabolismu glukózy ve skeletu. Na dalším PET/CT v srpnu 2018 došlo k částečné regresi generalizované viabilní neoplazie ve všech minule popsaných ložiscích. Tato regrese trvala až do 28.1.2020, kdy na PET/CT byla popsána progrese ložiska v apexu levé plíce, nodulů v horním laloku subpleurálně, progredující uzliny v mediastinu vlevo aortopulmonálně. Ve snaze o prokázání rezistentní mutace T790M jsme provedli odběr k vyšetření tekuté biopsie, žádná mutace však prokázána nebyla. Proto byla 24. 2. 2020 indikována transtorakální biopsie pod CT kontrolou; histologie opět potvrdila nízce diferencovaný solidně a acinárně rostoucí adenokarcinom a přítomnost aktivační mutace v L858R v exonu 21 genu pro EGFR a nově sekundární rezistentní mutaci T790M v exonu 20 genu pro EGFR. Za zmínku jistě stojí, že v den provedení transtorakální biopsie byl rovněž proveden odběr k vyšetření tekuté biopsie, která byla opět bez průkazů mutací. Léčba gefitinibem byla ukončena a 9. 3. 2020 byla zahájena léčba osimertinibem (Tagrisso). Na kontrolním PET/CT 10. 6. 2020 byla patrná rozměrová a výrazná parciální metabolická regrese vícečetných ložisek v levé plíci a levostranných mediastinálních uzlin (obr. 1 a 2). Kontrolní PET/CT v září 2020 bylo hodnoceno jako stabilizace nemoci. Pacientka při velmi dobré kvalitě života v léčbě pokračuje, z nežádoucích účinků udává pouze občas řidší stolici bez nutnosti léčby.
ZÁVĚR
Výše uvedená kazuistika ukazuje na nutnost molekulárně genetického vyšetření. Při průkazu genetických aberací, v tomto případě mutací v genu EGFR, je pak indikována léčba EGFR TKI. V České republice stále není stanovena úhrada osimertinibu (Tagrisso) v 1. linii léčby, proto musí být léčba zahájena EGFR TKI 1. nebo 2. generace. Při progresi pak musíme myslet především na vznik rezistentní mutace T790M, při jejímž prokázání je indikována léčba osimertinibem. K průkazu můžeme využít tekutou biopsii, ale jak naše kazuistika dokumentuje, její výtěžnost je nižší, proto při negativním výsledku je nutné zvážení rebiopsie.
LITERATURA
- Yu HA, Arcila ME, Rekhtman N, et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013;19:2240-2247.
- Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629-640.
- Soria JC, Ohe Y, Vansteenkiste J, et al.; FLAURA Investigators. Osimertinib in untreated EGFRm NSCLC. N Engl J Med 2018;3:113-125.
- Vansteenkiste J, Reungwetwattana T, Nakagawa K, et al. CNS response to osimertinib vs standard-of-care EGFR-TKI as first-line treatment in patients with EGFRm advanced NSCLC: FLAURA. Presented at: European Society of Medical Oncology Asia Congress; 17-19 November 2017; Singapore. Abs LBA5.
- Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med 2020;382:41-50.
- Ramalingam SS, Cheng Y, Zhouet C, et al. Mechanisms of acquired resistance to first-line osimertinib: Preliminary data from the phase III FLAURA study. ESMO 2018; October 2018; Volume 29; Supplement 8; abstr LBA5.
- European medicines agency. SPC přípravku TAGRISSO 80 mg potahované tablety, TAGRISSO 40 mg potahované tablety, datum revize textu: 31. 8. 2018 [online]. Dostupné na: https://www.ema.europa.eu/en/documents/product-information/tagrisso-epar-product-information_cs.pdf