Midostaurin, aktuální přehled a klinické zkušenosti ÚHKT v roce 2021 - kazuistiky
06/2021
MUDr. Jan Válka, Ph.D.1,2; MUDr. Monika Krutská1,3; MUDr. Markéta Sobotková1; MUDr. Petr Soukup, MHA1
1 Ústav hematologie a krevní transfuze, Praha
2 Ústav klinické a experimentální hematologie 1. LF UK, Praha
3 1. lékařská fakulta Univerzity Karlovy, Praha
SOUHRN
Tento článek popisuje dvouleté zkušenosti s používáním přípravku midostaurin na našem pracovišti - v Ústavu hematologie a krevní transfuze (ÚHKT) v Praze. Po teoretickém úvodu a literárně publikovaných klinických zkušenostech je dále prostor věnován managementu léčby midostaurinem, klinickým zkušenostem, které vzešly z našeho souboru pacientů, krátkému zhodnocení dostupných výsledků a závěrem jsou popsány kazuistické případy. Midostaurin je cytostatikum ze skupiny inhibitorů FLT3 (FMS-like tyrosine kinase 3), který se v podobě tablet používá v kombinaci se standardní chemoterapií k léčbě nově diagnostikovaných akutních myeloidních leukemií s FLT3/ITD/TKD mutací. V současnosti se stále jedná o jediný přípravek z této skupiny, který má v České republice schválenou úhradu pro použití v 1-2 cyklech indukční léčby a ve 3-4 cyklech léčby konsolidační. Celkem jsme za dva roky midostaurin podali 18 pacientům v 37 cyklech. Dosažení kompletní remise, míra celkového přežití a přežití bez choroby se blíží údajům vycházejícím ze studie RATIFY. Při dodržování doporučení k léčbě midostaurinem je tento přípravek pacienty dobře tolerován. V kombinaci se standardní indukční a konsolidační léčbou nedochází v rámci našeho souboru k výraznému zvýšení rizika infekčních komplikací či jiných projevů toxicity nad obvyklý rámec léčby pacientů bez podávání midostaurinu.
Klíčová slova
akutní myeloidní leukemie, inhibitor FLT3, FMS-like tyrosine kinase 3, indukční a konsolidační léčba AML
SUMMARY
This article describes our 2-year experience with the administration of midostaurin at the Institute of Hematology and Blood Transfusion (IHBT) in Prague. A short theoretical section and review of published data is followed by the clinical experiences with midostaurin treatment management in our group of patients and a short evaluation of available results. The article ends with some case reports. Midostaurin is an FLT3 (FMS-like tyrosine kinase 3) inhibitor used in the form of tablets in combination with standard chemotherapy in the treatment of patients with newly diagnosed acute myeloid leukemia (AML) and the FLT3/ITD/TKD mutation. To-date it remains the only preparation from this group registered and reimbursed in the Czech Republic for 1-2 cycles of induction therapy and 3-4 cycles of consolidation therapy. Over two years, we administered midostaurin to a total of 18 patients in 37 cycles of chemotherapy. Complete remission rate, overall survival and disease-free survival concur with the data from the RATIFY study. By adhering to the relevant recommendations, treatment with midostaurin is well tolerated. We did not record in our sample of patients treated with midostaurin and standard chemotherapy any increase in the risk of infectious complications or unusual toxicities compared to patients not receiving midostaurin.
Key words
acute myeloid leukemia, FLT3 inhibitor, FMS-like tyrosine kinase 3, induction and consolidation treatment of AML
ÚVOD
Midostaurin, přípravek ze skupiny inhibitorů FLT3 (FMS-like tyrosine kinase 3) první generace, je v současné době již standardně užíván spolu se systémovou chemoterapií v terapii pacientů s diagnózou akutní myeloidní leukemie (AML) s přítomnou mutací kinázy FLT3.
Midostaurin je indikován v léčbě dospělých pacientů s nově diagnostikovanou akutní myeloidní leukemií s mutací genu FLT3, a to ve třech možných fázích léčby. V indukční terapii AML je podáván v kombinaci se standardní chemoterapií daunorubicinem a cytosinarabinosidem s cílem dosažení kompletní hematologické remise onemocnění. V konsolidační terapii je podáván v kombinaci s vysokodávkovaným cytosinarabinosidem s cílem zajistit trvání kompletní remise a zabránit relapsu onemocnění. U pacientů v kompletní remisi základního onemocnění je indikován jako následná udržovací monoterapie - s cílem udržení kompletní remise a zabránění či maximálního oddálení relapsu onemocnění. Udržovací monoterapie v současné době není v České republice ze zdravotního pojištění hrazena.
Midostaurin je užíván perorálně v dávce 50 mg (tedy 2 tobolky po 25 mg) 2x denně ve 12hodinových intervalech. Přípravek je podáván 8. až 21. den cyklu chemoterapie (indukční i konsolidační). Z farmakokinetických důvodů by měl být midostaurin užíván s jídlem pro zvýšení účinnosti (AUC +22 %) a snížení maximální koncentrace (Cmax -20 %).1
MECHANISMUS ÚČINKU
Rozlišujeme dva typy mutací v kináze FLT3: častější FLT3-ITD (internal tandem duplication), při které dochází k duplikaci části genu kódujícího FLT3 kinázu, a FLT3-TKD (thyrosine kinase domain), která je způsobena bodovou mutací v části genu kódujícího funkční tyrosinkinázovou doménu FLT3 kinázy. Mutovanou variantu kinázy FLT3 detekujeme asi u 30 % pacientů s de novo vzniklou AML, přičemž ve třech čtvrtinách případů se jedná o typ mutace FLT3-ITD. Přítomnost mutace FLT3-ITD je spojena s nižší pravděpodobností dosažení kompletní remise po indukční terapii, vyšší četností relapsů, zejména v časném období po dosažení kompletní remise, a celkově zhoršuje prognózu pacientů. Ukazuje se, že míra zhoršení prognózy nemocných je spojena s procentuálním zastoupením mutované alely kinázy FLT3. U zbylé čtvrtiny případů AML s mutací FLT3 kinázy je nalézána mutace FLT3-TKD; její vliv na prognózu AML není tak zřejmý, ale pravděpodobně je též spojena s nepříznivou prognózou. U tohoto typu mutace nebyl prokázán benefit podávání midostaurinu.2
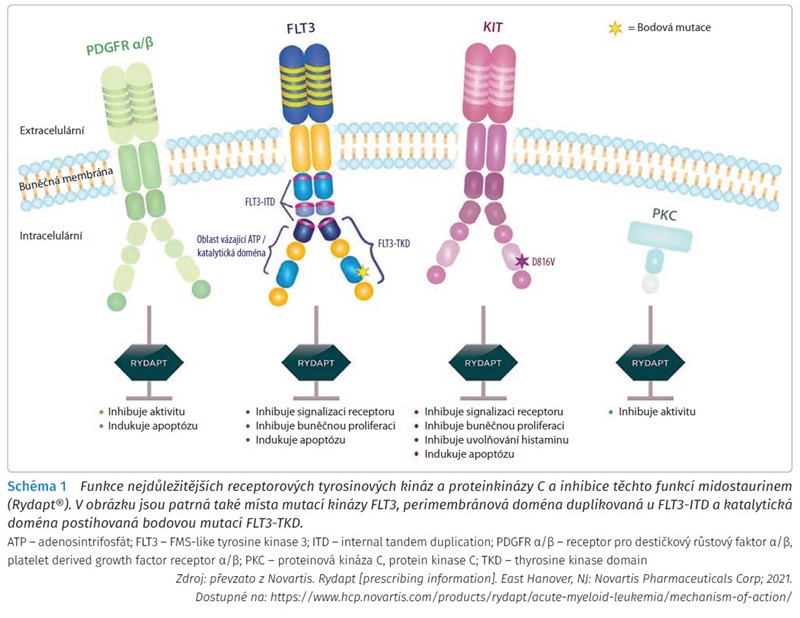
Mechanismus účinku midostaurinu spočívá v inhibici receptorových tyrosinových kináz (FLT3, KIT, receptor růstového faktoru odvozeného z destiček [platelet derived growth factor receptor, PDGFR] α/β, receptor vaskulárního endoteliálního růstového faktoru 2 [vascular endothelial growth factor receptor 2, VEGFR2]) a serin/threoninových kináz (proteinkináza C), dochází tak k inhibici signalizace růstových faktorů a je zastaven buněčný růst. Kináza FLT3 za fyziologických podmínek podporuje buněčnou proliferaci aktivací příslušných signálních drah.3 V případě mutace kinázy FLT3 se tato prorůstově působící signalizace vymyká regulačním mechanismům, což má za následek nekontrolovatelnou proliferaci buněk současně s jejich sníženou diferenciací. Tento proces může v případě krvetvorných buněk vést ke vzniku akutní myeloidní leukemie.4 Funkce hlavních kináz a mechanismus účinku midostaurinu zachycuje schéma 1.
KLINICKÉ ZKUŠENOSTI Z LITERATURY
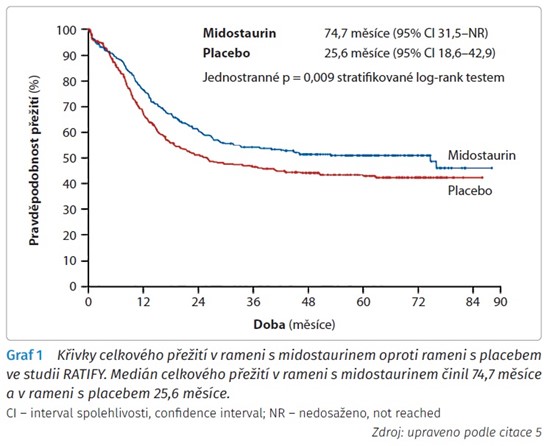 Studie RATIFY hodnotila účinnost midostaurinu oproti placebu v kombinaci se standardní chemoterapií 3 + 7 u pacientů s nově diagnostikovanou AML. Celkem bylo do tohoto klinického hodnocení fáze 3 zařazeno 717 pacientů ve věku 18 až 65 let. V rozšířené části poté studie srovnávala účinek udržovací monoterapie midostaurinem oproti placebu po dobu jednoho roku. Medián celkového přežití (overall survival, OS) v rameni s kombinací standardní indukční chemoterapie s midostaurinem činil 74,7 měsíce (95% interval spolehlivosti [confidence interval, CI] 31,5 - nedosaženo), v rameni s placebem pouze 25,6 měsíce (95% CI 18,6-42,9). Údaje celkového přežití zahrnovaly i dobu po provedení alogenní transplantace. Výsledek studie ukazuje graf 1. Kompletní remise (do 60. dne od zahájení indukční terapie) dosáhlo v rameni s midostaurinem 65 % pacientů oproti 58 % pacientů v rameni s placebem. Medián přežití bez nemoci (disease free survival, DFS) činil při terapii s midostaurinem 26,7 měsíce (95% CI 19,4 - nedosaženo), při léčbě chemoterapií s placebem potom 15,5 měsíce (95% CI 11,3-23,5). Incidence relapsu do jednoho roku od diagnózy dosáhla v rameni s midostaurinem 26 %, naproti tomu v rameni s placebem 41 %.
Studie RATIFY hodnotila účinnost midostaurinu oproti placebu v kombinaci se standardní chemoterapií 3 + 7 u pacientů s nově diagnostikovanou AML. Celkem bylo do tohoto klinického hodnocení fáze 3 zařazeno 717 pacientů ve věku 18 až 65 let. V rozšířené části poté studie srovnávala účinek udržovací monoterapie midostaurinem oproti placebu po dobu jednoho roku. Medián celkového přežití (overall survival, OS) v rameni s kombinací standardní indukční chemoterapie s midostaurinem činil 74,7 měsíce (95% interval spolehlivosti [confidence interval, CI] 31,5 - nedosaženo), v rameni s placebem pouze 25,6 měsíce (95% CI 18,6-42,9). Údaje celkového přežití zahrnovaly i dobu po provedení alogenní transplantace. Výsledek studie ukazuje graf 1. Kompletní remise (do 60. dne od zahájení indukční terapie) dosáhlo v rameni s midostaurinem 65 % pacientů oproti 58 % pacientů v rameni s placebem. Medián přežití bez nemoci (disease free survival, DFS) činil při terapii s midostaurinem 26,7 měsíce (95% CI 19,4 - nedosaženo), při léčbě chemoterapií s placebem potom 15,5 měsíce (95% CI 11,3-23,5). Incidence relapsu do jednoho roku od diagnózy dosáhla v rameni s midostaurinem 26 %, naproti tomu v rameni s placebem 41 %.
Studie RATIFY také ukázala specifické nežádoucí účinky, které jsou spojeny s terapií midostaurinem - prodloužení QTc intervalu na EKG s rizikem vzniku arytmie torsade de pointes a intersticiální plicní postižení. K prodloužení QTc intervalu nad hodnotu 480 ms došlo u 10,1 % pacientů užívajících midostaurin ve studii, prodloužení nad hodnotu 500 ms bylo pozorováno u 6,2 % pacientů.5 Tendence k prodloužení QTc intervalu je zvýšena při současném podávání silných inhibitorů enzymu CYP3A4, které zvyšují expozici midostaurinu (například azolová antimykotika, chinolony, makrolidy, setrony, a další).6 Postižení plic při terapii midostaurinem může mít podobu pneumonitidy nebo postižení plicního intersticia. Ve studii RATIFY bylo zaznamenáno u 11,4 % pacientů (z toho 3,1 % případů bylo plicní postižení přímo asociováno s midostaurinem).5 Stěžejním krokem k eliminaci plicní toxicity je neodkladné provedení vyšetření plic výpočetní tomografií s vysokým prostorovým rozlišením (high-resolution computed tomography, HRCT) u nemocných s respiračními příznaky a následně ukončení či přerušení podávání midostaurinu při průkazu plicního postižení na HRCT.
V současné době je účinnost, bezpečnost a role midostaurinu v terapii nemocných s AML intenzivně zkoumána. Recentní práce se zabývají rolí midostaurinu v udržovací terapii po alogenní transplantaci u pacientů s mutací FLT3-ITD7, je zkoumána role zastoupení mutované alely na účinnost terapie midostaurinem8, řeší se role midostaurinu v terapii pacientů s mutací FLT3-TKD9 nebo je diskutován problém vhodné antimykotické profylaxe při terapii midostaurinem.10,11 Podrobná analýza těchto prací přesahuje rámec tohoto sdělení, proto pro více informací odkazujeme na použitou literaturu.
KLINICKÉ ZKUŠENOSTI V ÚHKT
Od poloviny roku 2019 do doby přípravy tohoto článku jsme na našem pracovišti podali midostaurin celkem 18 pacientům s nově diagnostikovanou akutní myeloidní leukemií, kteří byli schopni podstoupit intenzivní terapii. Tito pacienti byli ve věkovém rozmezí 19-64 let, v souboru bylo 11 mužů a 7 žen. Frekvence variantní alely (VAF) genu FLT3 se u pacientů pohybovala mezi 3 až 83 %. Midostaurin jsme podávali podle doporučení výrobce v dávce 50 mg 2x denně. Celkem bylo podáno 37 cyklů terapie midostaurinem, 22 cyklů v indukční terapii spolu s daunorubicinem v dávce 60 mg/m2 v den 1 až den 3 (D1-D3), případně v D5-D7 u pacientů se vstupní hyperleukocytózou a cytosinarabinosidem v dávce 200 mg/m2 v kontinuální 24hodinové infuzi v D1-D7. Zbývajících 16 cyklů midostaurinu bylo podáno v konsolidační léčbě spolu s cytosinarabinosidem v dávce 1,5 g/m2 každých 12 hodin v D1-D3, případně v dávce 3 g/m2 po 12 hodinách v D1, D3 a D5. Počet cyklů indukce s midostaurinem u jednoho pacienta činil 1-2, počet konsolidačních cyklů s midostaurinem pak 1-3 a konečně celkový počet podaných cyklů midostaurinu u jednoho pacienta se pohyboval mezi 1 až 4 cykly.
 Kompletní hematologické remise po podání jedné indukce s midostaurinem dosáhlo 9 z 18 pacientů, a to 26-52 dnů od stanovení diagnózy, u dalších tří pacientů bylo k dosažení kompletní hematologické remise potřeba podání 2 cyklů indukce 3 + 7 s midostaurinem. Celkem tedy 12 z 18 pacientů (66,7 %) dosáhlo kompletní hematologické remise po podání 1-2 indukčních cyklů 3 + 7 s midostaurinem, a to 28-84 dnů od stanovení diagnózy. V registrační studii RATIFY bylo dosažení kompletní remise hodnoceno do dne 60 indukční terapie, v našem souboru by toto časové kritérium splnilo 10 z 18 pacientů (55,6 %), ve studii RATIFY byla tato hodnota 58,9 %. Celkem pět pacientů bylo primárně refrakterních na první indukční terapii a bylo nutno jim podat záchrannou terapii s fludarabinem (FLA-IDA), po které dosáhli kompletní hematologické remise tři pacienti a zbylí dva pacienti podstoupili sekvenční alogenní transplantaci s protokolem založeným na cladribinu12, po které zůstávají v kompletní remisi onemocnění. Kompletní hematologické remise po podání 1-2 indukčních cyklů chemoterapie tedy dosáhlo 15 z 18 pacientů v souboru (83,3 %). Poslední pacientka byla refrakterní na indukční terapii a dále nebylo možno pokračovat v intenzivní léčbě, nicméně dosáhla kompletní hematologické remise po 4 cyklech azacitidinu.
Kompletní hematologické remise po podání jedné indukce s midostaurinem dosáhlo 9 z 18 pacientů, a to 26-52 dnů od stanovení diagnózy, u dalších tří pacientů bylo k dosažení kompletní hematologické remise potřeba podání 2 cyklů indukce 3 + 7 s midostaurinem. Celkem tedy 12 z 18 pacientů (66,7 %) dosáhlo kompletní hematologické remise po podání 1-2 indukčních cyklů 3 + 7 s midostaurinem, a to 28-84 dnů od stanovení diagnózy. V registrační studii RATIFY bylo dosažení kompletní remise hodnoceno do dne 60 indukční terapie, v našem souboru by toto časové kritérium splnilo 10 z 18 pacientů (55,6 %), ve studii RATIFY byla tato hodnota 58,9 %. Celkem pět pacientů bylo primárně refrakterních na první indukční terapii a bylo nutno jim podat záchrannou terapii s fludarabinem (FLA-IDA), po které dosáhli kompletní hematologické remise tři pacienti a zbylí dva pacienti podstoupili sekvenční alogenní transplantaci s protokolem založeným na cladribinu12, po které zůstávají v kompletní remisi onemocnění. Kompletní hematologické remise po podání 1-2 indukčních cyklů chemoterapie tedy dosáhlo 15 z 18 pacientů v souboru (83,3 %). Poslední pacientka byla refrakterní na indukční terapii a dále nebylo možno pokračovat v intenzivní léčbě, nicméně dosáhla kompletní hematologické remise po 4 cyklech azacitidinu.
Celkem 14 pacientů z našeho souboru (77,8 %) dosud podstoupilo alogenní transplantaci krvetvorby, včetně tří pacientů v sekvenčním protokolu.12 U 7 z těchto 14 pacientů došlo k potransplantačnímu relapsu onemocnění. Ve všech případech, vzhledem ke krátké době sledování, se jednalo o potransplantační relaps do jednoho roku od transplantace. Alarmující je skutečnost, že 5 z těchto 7 relapsů bylo velmi časných, do 100 dnů po převodu štěpu. Ze zbývajících čtyř pacientů, kteří nepodstoupili alogenní transplantaci, jeden zemřel v době kompletní remise z nehematologické příčiny (tragicky), jedna pacientka po 11 měsících zrelabovala a brzy poté zemřela, jeden pacient (po jedné indukci a 3 konsolidacích s midostaurinem) je 13 měsíců od diagnózy naživu a v kompletní remisi, poslední pacient je aktuálně časně po dosažení kompletní remise a je indikován k transplantaci.
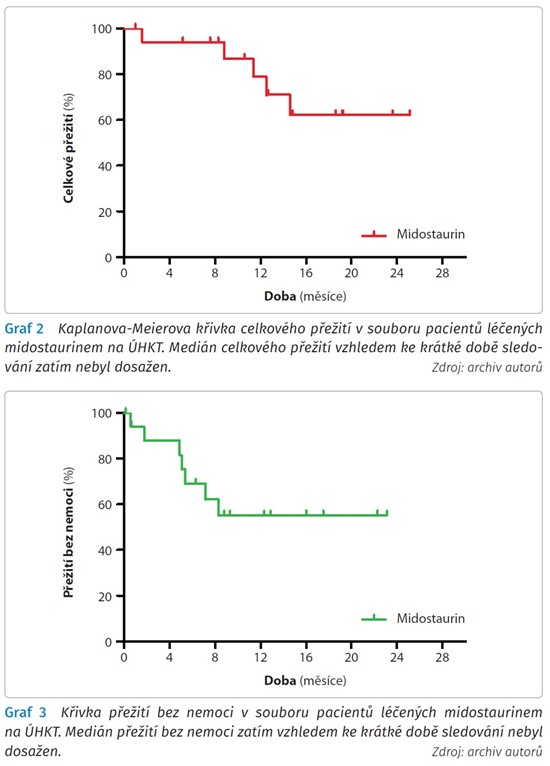
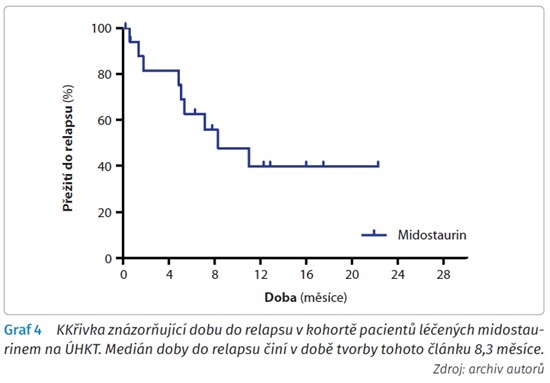
Z našeho souboru, při průměrné době sledování 15,5 měsíce a maximu 25,6 měsíce, v době přípravy článku žije 13 z 18 pacientů (72,2 %), medián celkového přežití od diagnózy při krátké době sledování zatím nebyl dosažen. Medián přežití bez nemoci při současném krátkém sledování taktéž nebyl dosažen. Medián doby do relapsu činí aktuálně 11 měsíců. Ze zemřelých pacientů tři pacienti zemřeli časně po potransplantačním relapsu choroby, jedna (výše zmíněná) pacientka zemřela v relapsu onemocnění bez provedení alogenní transplantace a poslední (taktéž výše zmíněný) pacient zemřel v době kompletní remise z nehematologické příčiny (tragicky). Křivku celkového přežití v našem souboru pacientů zachycuje graf 2. Křivku přežití bez nemoci graf 3 a křivku přežití bez relapsu graf 4.
MANAGEMENT TERAPIE MIDOSTAURINEM
 Na našem pracovišti jsme vypracovali interní soubor doporučení k minimalizaci toxicity nežádoucích účinků terapie midostaurinem, který vychází z SPC přípravku a dosud publikovaných klinických zkušeností. Souhrn těchto doporučení viz další text. Podle našich klinických zkušeností je midostaurin pacienty celkově velmi dobře tolerován, přidání midostaurinu ke standardní indukční terapii není spojeno s významnějším prodloužením cytopenie a nepozorovali jsme závažné zhoršení projevů toxicity terapie. Přerušit či ukončit cyklus podávání přípravku bylo nutno pouze v 5 ze 37 podaných cyklů (ve většině případů v době indukční terapie). Příčinou byl ve dvou případech rozvoj intersticiální pneumonie, v jednom případě došlo u pacienta k rozvoji tako-tsubo kardiomyopatie v souvislosti se základní diagnózou, jeden cyklus bylo nutno ukončit pro infekci COVID-19 s následnou bilaterální pneumonií a v posledním případě bylo nutno krátkodobě přerušit podávání midostaurinu pro excesivní nauzeu se zvracením. U jednoho pacienta jsme podali jeden cyklus midostaurinu v redukované dávce 2x 25 mg denně pro opakovaně prodloužené hodnoty QTc intervalu.
Na našem pracovišti jsme vypracovali interní soubor doporučení k minimalizaci toxicity nežádoucích účinků terapie midostaurinem, který vychází z SPC přípravku a dosud publikovaných klinických zkušeností. Souhrn těchto doporučení viz další text. Podle našich klinických zkušeností je midostaurin pacienty celkově velmi dobře tolerován, přidání midostaurinu ke standardní indukční terapii není spojeno s významnějším prodloužením cytopenie a nepozorovali jsme závažné zhoršení projevů toxicity terapie. Přerušit či ukončit cyklus podávání přípravku bylo nutno pouze v 5 ze 37 podaných cyklů (ve většině případů v době indukční terapie). Příčinou byl ve dvou případech rozvoj intersticiální pneumonie, v jednom případě došlo u pacienta k rozvoji tako-tsubo kardiomyopatie v souvislosti se základní diagnózou, jeden cyklus bylo nutno ukončit pro infekci COVID-19 s následnou bilaterální pneumonií a v posledním případě bylo nutno krátkodobě přerušit podávání midostaurinu pro excesivní nauzeu se zvracením. U jednoho pacienta jsme podali jeden cyklus midostaurinu v redukované dávce 2x 25 mg denně pro opakovaně prodloužené hodnoty QTc intervalu.
Z důvodu známých lékových interakcí a k prevenci popisovaných nežádoucích účinků léčby se na našem pracovišti při podávání midostaurinu řídíme následujícími interními doporučeními.
a) Terapie azolovými antimykotiky - v indukční léčbě AML podáváme standardní antimykotickou profylaxi posaconazolem i při terapii midostaurinem, vzhledem ke zvýšenému riziku prodloužení QTc intervalu a vzniku arytmie typu torsade de pointes volíme častější monitorování EKG a při známkách prodloužení QTc intervalu přecházíme na antimykotickou profylaxi micafunginem.
b) Terapie chinolony - na našem pracovišti standardně podáváme u neutropenických pacientů profylaxi ciprofloxacinem, v případě terapie midostaurinem volíme profylaxi cefuroximem nebo amoxicillin-clavulanátem nebo parenterální terapii piperacillin-tazobactamem. U infekčních pacientů volíme parenterální antibiotika podle zvyklostí. Případnou terapii chinolonem ukončujeme alespoň 48 hodin před zahájením podávání midostaurinu.
c) Profylaxe nauzey a zvracení - standardní profylaxi granisetronem v dávce 3 mg každých 12 hodin vysazujeme nejpozději 48 hodin od podání midostaurinu, u nemocných se zvýšeným rizikem rozvoje nauzey nebo zvracení volíme další profylaxi metoclopramidem. V individuálních případech lze pro terapii nevolnosti a zvracení užít olanzapin, eventuálně setrony v redukovaných dávkách - granisetron 1 mg nebo palonosetron 0,25 mg.
d) Podání přípravku s jídlem - při podávání tablety midostaurinu současně s jídlem je popisováno zvýšení účinnosti (AUC +22 %) a snížení maximální koncentrace (Cmax -20 %); to je současně prevencí nauzey a zvracení po midostaurinu.
e) Monitoring EKG - v prvním týdnu po zahájení terapie midostaurinem monitorujeme QTc interval na EKG křivce 2x týdně, při profylaxi posaconazolem potom 3x týdně - viz bod a), v dalším průběhu terapie a v konsolidačních cyklech kontrolujeme EKG 1x týdně, při současném podávání rizikové medikace (s možností prodloužení QTc) potom alespoň 2x týdně. Současně kontrolujeme mineralogram (kalium denně, kalcium, magnesium alespoň 3x týdně) a snažíme se o udržení iontové homeostázy. Při prodloužení QTc intervalu > 480 ms přerušujeme podávání midostaurinu, revidujeme medikaci podávanou pacientovi a kontrolujeme mineralogram, po poklesu < 480 ms vracíme midostaurin v plné dávce se současnou častější kontrolou EKG.
f) Intersticiální plicní postižení - při rozvoji plicních symptomů, zejména dušnosti, a hyposaturaci s potřebou oxygenoterapie neodkladně odesíláme nemocného k HRCT vyšetření plic. V případě nálezu intersticiálního postižení plic v HRCT obraze podávání midostaurinu ihned přerušujeme.
KAZUISTIKA 1
Tato kazuistika pojednává o 38letém muži, dosud zdravém, který byl na naše pracoviště odeslán praktickým lékařem pro měsíc trvající faryngitidu, nereagující na antibiotickou terapii. Ve vyšetření krevního obrazu v ambulanci praktického lékaře byly zjištěny tyto hodnoty: leukocyty 56 x 109/l (z toho 60 % blastických elementů), hemoglobin 76 g/l, trombocyty 149 x 109/l. Pacient byl pro suspekci na akutní leukemii předán do péče ÚHKT. Zde byla stanovena 1. 4. 2020 diagnóza akutní myeloidní leukemie s vyzráváním podle World Health Organization (WHO), AML M2 podle French-American-British (FAB) klasifikace, FLT3-ITD pozitivní, NPM1 nemutovaný, cytogeneticky 46,XY. Při diagnóze bylo morfologicky v aspirátu kostní dřeně přítomno 75 % myeloidních blastů, 66 % myeloidních blastů bylo v aspirátu zjištěno průtokovou cytometrií. Po provedení jedné depleční leukocytaferézy byla dne 4. 4. 2020 zahájena indukce 3 + 7. Indukční terapie byla od 4. dne komplikována rozvojem febrilní neutropenie a 5. den rozvojem toxoalergického exantému. Od 8. do 21. dne indukce byl podáván perorálně midostaurin v dávce 50 mg po 12 hodinách. Přípravek byl pacientem dobře tolerován a nedošlo k rozvoji komplikací. V den 14 indukce bylo provedeno vyšetření aspirátu kostní dřeně s morfologickým nálezem dřeňové aplazie. V den 21 bylo v aspirátu kostní dřeně podle morfologie přítomno 22 % zčásti suspektních myeloidních blastů a v den 28 při protrahované reparaci krevního obrazu bylo morfologicky stále přítomno 12 % blastů. Stejné procento blastických buněk odhalila také průtoková cytometrie, specifický leukemický imunofenotyp (leukemia associated phenotype, LAIP) byl negativní, avšak vstupní LAIP nebyl jednoznačně indikativní. Aspirace kostní dřeně byla, při stále trvající neutropenii, opakována ještě ve dnech 40 a 47 indukce, kdy bylo morfologicky stále přítomno 16 % LAIP negativních blastů. Z důvodu inkompletní reparace krevního obrazu a přetrvávání signifikantní populace blastů bylo rozhodnuto o podání druhé indukce 3 + 7 s midostaurinem, která byla zahájena dne 20. 5. 2020. Podání druhé indukce bylo opět komplikováno rozvojem exantému, biopsie ovšem vyloučila leukemickou infiltraci kůže, a v den 12 rozvojem febrilní neutropenie. Od 8. do 21. dne byl opět nekomplikovaně podán midostaurin v obvyklé dávce. Kontrola onemocnění v aspirátu kostní dřeně v den 21 neprokázala zmnožení myeloidních blastů, průtokovou cytometrií bylo detekováno 2,4 % blastů. V den 32 druhé indukce pacient dosáhl první kompletní hematologické remise. Od 1. 7. 2020 byla pacientovi plánovaně podána první konsolidace střednědávkovaným cytarabinem (intermediate dose cytarabin, IDAC), ve dnech 8 až 21 doplněna midostaurinem ve standardní dávce 50 mg každých 12 hodin. Konsolidační cyklus byl komplikován febrilní neutropenií. V aspirátu kostní dřeně po reparaci krvetvorby po podání první konsolidace bylo ověřeno trvání remise onemocnění. Pro nedostupnost adekvátního dárce krvetvorby ve vhodném termínu byla pacientovi podána od 18. 8. 2020 ještě zcela nekomplikovaná, druhá konsolidace IDAC s midostaurinem. Po ověření trvající remise pacient podstoupil alogenní transplantaci periferních progenitorových buněk (peripheral blood progenitor cell, PBPC) od HLA (human leukocyte antigen) shodného nepříbuzného dárce, po myeloablativním přípravném režimu s fludarabinem a busulfanem byly dne 7. 10. 2020 převedeny periferní progenitorové buňky. Profylaxe reakce štěpu proti hostiteli (graft versus host disease, GvHD) sestávala z potransplantačního cyklofosfamidu, cyklosporinu a mykofenolát mofetilu. Doba přihojení štěpu nebyla prodloužena. V prvních sedmi měsících po transplantaci nebyly u nemocného přítomny žádné projevy GvHD, u pacienta trvala první kompletní remise. Po snížení dávky cyklosporinu došlo k rozvoji mírné formy chronické GvHD s otoky dolních končetin. Po opětovném (a dočasném) navýšení cyklosporinu a krátkodobé kortikoterapii došlo k ústupu obtíží. Aktuálně je pacient 12 měsíců od transplantace krvetvorby v celkově dobrém klinickém stavu, známky chronické GvHD jsou dobře kontrolovány a u pacienta trvá kompletní hematologická remise onemocnění.
KAZUISTIKA 2
Druhá kazuistika popisuje případ 54letého pacienta, u kterého byla dne 13. 3. 2020 stanovena diagnóza akutní myeloidní leukemie s dysplastickými rysy (acute myeloid leukemia with myelodysplasia-related changes, AML-MRC) podle WHO, AML M2 podle FAB klasifikace, FLT3-ITD pozitivní, NPM1 nemutovaný, cytogeneticky 47,XY, +8 (podle fluorescenční in situ hybridizace [FISH] s průkazem nadpočetné kopie genů MLL a NUP98). V diagnostickém aspirátu kostní dřeně bylo podle morfologického vyšetření přítomno 25 % myeloidních blastů, 27 % myeloidních blastů prokázala průtoková cytometrie s indikativním vstupním LAIP. Pacient byl anamnesticky bez interních komorbidit. Diagnóze předcházela asi dva měsíce trvající progredující únava a námahová dušnost. Dne 11. 2. 2020 pacient prodělal kolapsový stav a byl hospitalizován na interním oddělení spádové nemocnice. V krevním obraze byla již tehdy přítomna pancytopenie: leukocyty 2x 109/l, hemoglobin 70 g/l, trombocyty 70x 109/l, a v diferenciálním rozpočtu leukocytů bylo přítomno 7 % myeloidních blastů. Stav byl uzavřen jako megaloblastová anemie z deficitu vitaminu B12 a kyseliny listové. Pacientovi byly podány dvě transfuzní jednotky erymasy a bylo naplánováno kontrolní hematologické vyšetření na počátek března 2020. Až při tomto vyšetření byla provedena aspirace kostní dřeně, která vedla k podezření na akutní leukemii, a pacient byl předán do péče ÚHKT. Zde byla stanovena výše zmíněná diagnóza a dne 17. 3. 2020 byla zahájena indukce 3 + 7 s midostaurinem podávaným od 8. do 21. dne v dávce 50 mg po 12 hodinách. Indukční terapie byla komplikována opakovanými epizodami febrilní neutropenie, až nakonec 23. den terapie došlo k rozvoji septického stavu s hypotenzí a potřebou přechodné katecholaminové podpory. Kontrola onemocnění v aspirátu kostní dřeně v den 21 morfologicky prokázala reparující kostní dřeň bez zmnožení blastů, podle průtokové cytometrie nebyly přítomny LAIP pozitivní blasty. V den 35 morfologicky přetrvával reparační charakter dřeně bez zmnožených blastů, byla opožděna reparace granulocytů. Teprve dne 4. 5. 2020 (54. den indukce) byla dosažena první kompletní remise, s dokončenou reparací krvetvorby. Následně byla od 6. 5. 2020 podána první konsolidace vysokodávkovaným cytarabinem (high dose cytarabin, HIDAC), od 8. do 21. dne cyklu opět s přidáním midostaurinu. Konsolidace byla komplikována febriliemi a dyspeptickými obtížemi horního typu během aplikace cytosinarabinosidu. Období cytopenie se obešlo bez závažnějších komplikací. Reparace krevního obrazu byla dokončena 35. den cyklu. Po ověření trvání první kompletní remise v aspirátu kostní dřeně podstoupil pacient alogenní transplantaci PBPC od HLA shodného bratra. Převod progenitorových buněk byl proveden dne 24. 6. 2020 po myeloablativním přípravném režimu s fludarabinem a busulfanem, profylaxe GvHD byla založena na mykofenolát mofetilu a takrolimu. Doba přihojení štěpu nebyla prodloužena. V den +22 po převodu se rozvinula akutní GvHD kůže a dolního gastrointestinálního traktu, po pulsu kortikosteroidů symptomy GvHD zcela ustoupily. Z důvodu přetrvávajícího smíšeného chimérismu kostní dřeně pět měsíců po transplantaci byly dne 15. 12. 2020 převedeny dárcovské lymfocyty (DLI). Pět měsíců po aplikaci dárcovských lymfocytů bylo u nemocného dosaženo mikrochimérismu bez rozvoje GvHD. Aktuálně je pacient 15 měsíců po alogenní transplantaci PBPC a 8 měsíců po aplikaci dárcovských lymfocytů v trvající první kompletní remisi, bez známek GvHD a ve velmi dobrém klinickém stavu.
ZÁVĚR
Při svědomitém dodržování doporučení k bezpečnému zvládání terapie přípravkem midostaurin, jehož účelem je minimalizace toxicity a rozvoje nežádoucích účinků, lze na základě našich klinických zkušeností jednoznačně říci, že je midostaurin pacienty velmi dobře tolerován. V kombinaci se standardní chemoterapií (indukční i konsolidační) nedochází k výraznému prodloužení doby cytopenie a tím ke zvýšení rizika infekčních komplikací či jiných projevů toxicity, nad míru pozorovanou u pacientů léčených bez midostaurinu.
Výsledky dosažení kompletní remise, celková míra přežití a míra přežití bez relapsu se příliš neliší od dat publikovaných v rámci studie RATIFY. Podrobnější zhodnocení našich výsledků včetně srovnání s historickou skupinou léčenou bez midostaurinu máme v plánu s odstupem času, s vyšším počtem pacientů a delší dobou sledování.
LITERATURA
- SPC Rydapt [online]. Novartis Pharma AG 2017; revize 2018. Dostupné na: https://ec.europa.eu/health/documents/community-register/2018/ 20180430140856/anx_140856_cs.pdf
- Kottaridis PD, Gale RE, Frew ME, et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML 10 and 12 trials. Blood 2001;98:1752-1759.
- Fathi AT, Chabner BA. FLT3 inhibition as therapy in AML: a record of trials and tribulations. Oncologist 2011;16:1162-1174.
- Kelly LM, Liu Q, Kutok JL, et al. FLT3 internal tandem duplication mutations associated with human acute myeloid leukemias induce myeloproliferative disease in a murine bone marrow transplant model. Blood 2002;99:310-318.
- Stone RM, Mandrekar S, Sanford BL, et al. Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med 2017;377:454-464.
- Schlafer D. Management of midostaurin-CYP3A4 drug-drug interactions in patients with acute myeloid leukemia. Oncology (Williston Park) 2019;33:629381.
- Maziarz RT, Levis M, Patnaik MM, et al. Midostaurin after allogeneic stem cell transplant in patients with FLT3-internal tandem duplication-positive acute myeloid leukemia. Bone Marrow Transplant 2021;56:1180-1189.
- Ofran Y, Leiba R, Frisch A, et al. Midostaurin in combination with chemotherapy is most effective in patients with acute myeloid leukemia presenting with high FLT3-ITD allelic ratio who proceed to allogeneic stem cell transplantation while in first complete remission. Eur J Haematol 2021;106:64-71.
- Voso MT, Larson RA, Jones D, et al. Midostaurin in patients with acute myeloid leukemia and FLT3-TKD mutations: a subanalysis from the RATIFY trial. Blood Adv 2020;4:4945-4954.
- Stemler J, Koehler P, Maurer Ch, et al. Antifungal prophylaxis and novel drugs in acute myeloid leukemia: the midostaurin and posaconazole dilemma. Ann Hematol 2020;99:1429-1440.
- Menna P, Salvatorelli E, Del Principe MI, et al. Choosing antifungals for the midostaurin-treated patient: does CYP3A4 outweigh recommendations? A brief insight from real life. Chemotherapy 2021;66:47-52.
- Vydra J, Válková V, Čemusová B, et al. Hematopoietic stem cell transplantation from haploidentical donors in aplasia after cladribine/cytarabine chemotherapy for refractory acute myeloid leukemia or myelodysplastic syndrome. Clin Lymphoma Myeloma Leuk 2019;19:365-371.