Konsolidační imunoterapie durvalumabem v léčbě lokálně pokročilého nemalobuněčného karcinomu plic
01/2021
MUDr. Ondřej Bílek
Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno
SOUHRN
Nemalobuněčný karcinom plic je asi v jedné čtvrtině případů diagnostikován ve stadiu lokálně pokročilého onemocnění. Standardní léčbu těchto pacientů dlouhodobě představuje konkomitantní chemoterapie a radioterapie. V současné době je již nedílnou součástí léčebného algoritmu imunoterapie, zejména checkpoint inhibitory - inhibitorem receptoru programované buněčné smrti 1 (programmed cell death protein 1, anti-PD-1) a protilátkou proti ligandu programované buněčné smrti 1 (programmed cell death-ligand 1, anti-PD-LI). Studie PACIFIC v rámci čtyřletého sledování prokázala významný přínos konsolidační imunoterapie anti-PD-L1 monoklonální protilátkou durvalumabem po ukončení radioterapie, včetně prodloužení celkového přežití. Durvalumab aktuálně představuje referenční molekulu v této indikaci. Tolerance a bezpečnostní profil jsou příznivé, je nutná včasná diagnostika a léčba imunitně podmíněných nežádoucích účinků.
Klíčová slova
nemalobuněčný karcinom plic, imunoterapie, durvalumab
SUMMARY
In about a quarter of cases, non-small cell lung cancer (NSCLC) is diagnosed at the stage of locally advanced disease. The standard treatment for these patients is concomitant chemotherapy and radiotherapy. Currently, immunotherapy is an integral part of the treatment of the NSCLC treatment algorithm, especially anti-PD-1 and anti-PD-L1 check-point inhibitors. Data from the PACIFIC study demonstrated a significant benefit of consolidating immunotherapy with the anti-PD-L1 monoclonal antibody durvalumab after cessation of radiotherapy, including prolongation of overall survival. Durvalumab is currently the reference molecule in this indication. Tolerance and safety profile are favorable, early diagnosis and treatment of immune-related adverse events is necessary.
Key words
non-small cell lung cancer, immunotherapy, durvalumab
ÚVOD
Asi čtvrtina případů nemalobuněčného karcinomu plic (non-small cell lung cancer, NSCLC) je diagnostikována ve stadiu lokálně pokročilého neoperabilního onemocnění.1 Standardní léčbu těchto pacientů dlouhodobě představuje konkomitantní chemoterapie a radioterapie (concomitant chemotherapy and radiotherapy, CRT).2 Poslední desetiletí přineslo rozvoj nových strategií imunoterapie založených na porozumění funkce inhibičních molekul, které se podílejí na přerušení protinádorové imunitní odpovědi, jako jsou cytotoxický antigen 4 asociovaný s T lymfocyty (cytotoxic T-lymphocyte antigen 4, CTLA-4), receptor programované buněčné smrti 1 (programmed cell death 1, PD-1) a ligand programované buněčné smrti 1 (programmed cell death-ligand 1, PD-L1).3 Studie PACIFIC prokázala významný přínos konsolidační imunoterapie anti-PD-L1 monoklonální protilátkou durvalumabem po ukončení radioterapie, včetně prodloužení celkového přežití (overall survival, OS). Začátkem roku 2021 bude v České republice standardně k dispozici konsolidační imunoterapie durvalumabem po chemoterapii a radioterapii u pacientů s lokálně pokročilým neoperabilním NSCLC s pozitivní expresí PD-L1.
MECHANISMUS ÚČINKU DURVALUMABU
Durvalumab (MEDI4736) je plně humanizovaná IgGK anti-PD-L1 monoklonální protilátka. Vazbou na PD-L1 blokuje interakci s PD-1 a CD80 a tím umožňuje obnovu imunitní protinádorové reakce a terapeutický účinek.4 Proteinový receptor PD-1 je exprimován na aktivovaných cytotoxických T lymfocytech. Jsou známy dva ligandy PD-L1 (B7-H1) a PD-L2, které jsou exprimovány na T lymfocytech, B lymfocytech, antigen prezentujících (antigen presenting cells, APC) a stromálních buňkách a mohou být exprimovány rovněž na nádorových buňkách. PD-L1 má vazbu buď k PD-1, nebo k CD80 (B7-1) exprimovaném na aktivovaných T lymfocytech nebo APC. Interakce mezi PD-L1 a PD-1/CD80 vede k inhibici aktivace T lymfocytu a přerušení imunitní odpovědi.5 Nádorové buňky, které exprimují PD-L1, mohou prostřednictvím tohoto receptoru vypnout imunitní reakci cytotoxických T lymfocytů vůči nim a znemožnit tak imunitní dohled nad nádorovými buňkami. Durvalumab selektivně blokuje interakci mezi PD-L1 a PD-1/CD80 a zabrání utlumení imunitní reakce.
SYNERGICKÝ POTENCIÁL RADIOTERAPIE A IMUNOTERAPIE
Pacienti s lokálně pokročilým inoperabilním NSCLC jsou standardně léčení radioterapií a chemoterapií založené na derivátu platiny. Konkomitantní aplikace CRT byla spojena s lepšími výsledky léčby.2 Preklinická data konzistentně ukazují benefit kombinace anti-PD-L1 imunoterapie s radioterapií.6 Vzájemná interakce nádorových buněk a imunitního systému je podstatou tzv. imunitního dohledu (cancer immunoediting).7 Radioterapie se podílí na redukci nádorových buněk prostřednictvím apoptózy, nekrózy, mitotické katastrofy, autofagie či stárnutí (senescence). Prostřednictvím těchto mechanismů může „zviditelnit1" nádorové antigeny pro vrozené a adaptivní složky imunitního systému. Dochází k aktivaci cytotoxických T lymfocytů či zvýšené expresi hlavního histokompatibilního komplexu (major histocompatibility complex, MHC) I. třídy.8 Indukcí reakce T lymfocytů proti specifickému antigenu může navodit léčebnou odpověď i mimo ozařované pole, známou jako abskopální efekt.9 Poškození nádorové DNA bývá spojeno se vznikem neoantigenů a následná imunitní reakce může vést k obnovení imunitního dohledu.
DURVALUMAB V LÉČBĚ LOKÁLNĚ POKROČILÉHO NSCLC
Léčebný účinek durvalumabu byl zaznamenán již v léčbě metastazujícího NSCLC v rámci studií I. a II. fáze.10,11 Multicentrická dvojitě zaslepená studie III. fáze PACIFIC (NCT02125461) hodnotila efekt konsolidační léčby durvalumabem po standardní konkomitantní CRT u pacientů s lokálně pokročilým inoperabilním NSCLC III. klinického stadia.12
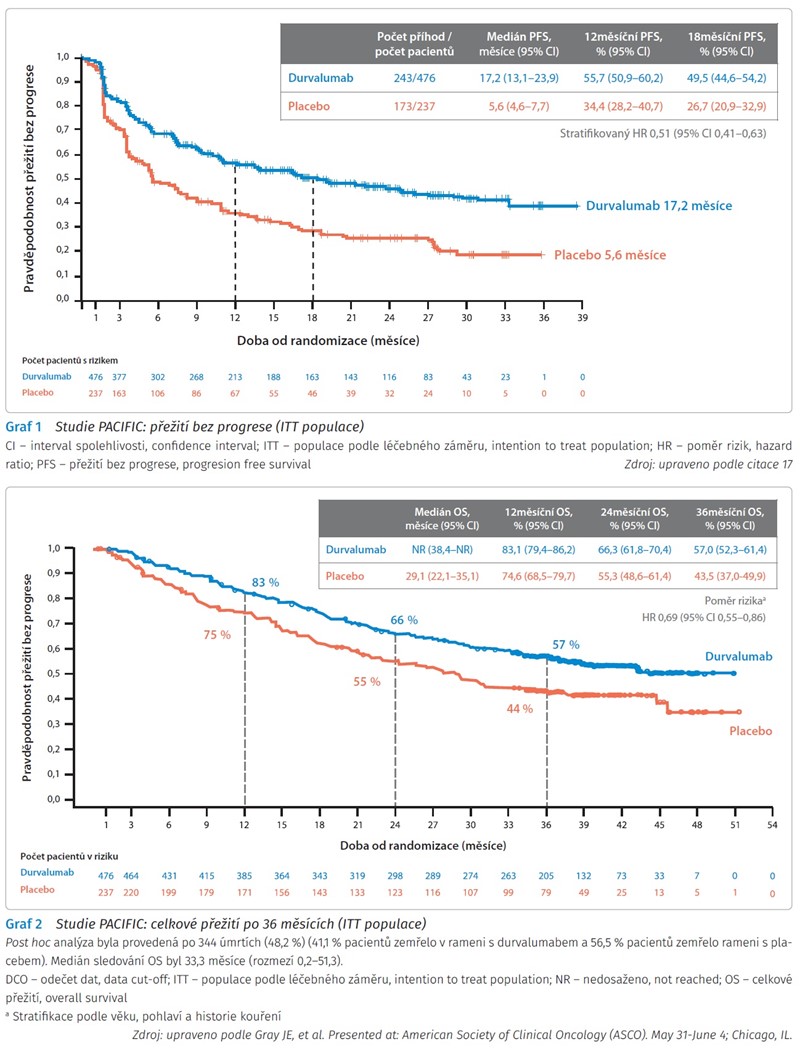
Zařazení pacienti absolvovali dva či více cyklů chemoterapie založené na platinovém derivátu konkomitantně s definitivní radioterapií v dávce 55-66 Gy. Bylo zařazeno 713 pacientů, kteří byli randomizováni v poměru 2 : 1 ve prospěch imunoterapie. Pokud nedošlo k progresi onemocnění, byla v horizontu 1-42 dní po ukončení CRT zahájena konsolidační aplikace durvalumabu v dávce 10 mg/kg tělesné hmotnosti ve dvoutýdenním intervalu, nebo placeba. Primární cíle představovaly parametry OS a přežití bez progrese onemocnění (progression free survival, PFS). Sekundární cíle byly PFS ve 12 a 18 měsících, celková četnost odpovědí (overall response rate, ORR), doba trvání odpovědi, doba do úmrtí / rozvoje vzdálených metastáz, OS ve 24 měsících, čas do druhé progrese onemocnění, bezpečnost léčby, kvalita života a farmakokinetika. Součástí studie bylo i hodnocení exprese PD-L1 v nádorové tkáni, stav exprese však neměl vliv na zařazení pacientů.
První interim analýza prokázala delší medián PFS 16,8 oproti 5,6 měsíce ve prospěch durvalumabu (poměr rizik [hazard ratio, HR] 0,52; 95% interval spolehlivosti [confidence interval, CI] 0,42-0,65; p < 0,001) (graf 1), dále vyšší ORR ve skupině s durvalumabem - 28,4 % oproti 16 % ve skupině s placebem (p < 0,001). V této analýze byl významně prodloužen čas do druhé progrese nebo úmrtí ve skupině s durvalumabem (medián 28,3 vs. 17,1 měsíce).13 Durvalumab však zejména přinesl významné zlepšení OS; v rámci čtyřletého sledování bylo dosaženo mediánu OS v rameni s durvalumabem 47,5 oproti 29,1 měsíce v rameni s placebem.14 Ve 12, 24 a 36 měsících přežívalo 83,1 vs. 74,6 %, 66,3 vs. 55,3 % a 57,0 vs. 43,5 % pacientů ve prospěch durvalumabu (HR 0,69; 95% CI 0,55-0,86)15 (graf 2). Prodloužení PFS a OS bylo zaznamenáno bez ohledu na použitý režim chemoterapie, dávku radioterapie nebo dobu od radioterapie do randomizace.
Zlepšení sledovaných parametrů bylo zaznamenáno u všech podskupin pacientů.16 V roce 2018 však byla prezentována post hoc analýza s cílem posouzení vlivu exprese PD-L1 na medián PFS. Ve skupině pacientů s PD-L1 ≥ 1 % bylo dosaženo mediánu PFS 17,8 měsíce v rameni s durvalumabem oproti 5,6 měsíce ve skupině s placebem. U pacientů s expresí PD-L1 < 1 % dosáhl medián PFS 10,7 měsíce v rameni s durvalumabem oproti 5,6 měsíce ve skupině s placebem (HR 0,73; 95% CI 0,48-1,1). U pacientů s PD-L1 < 1 % bylo zaznamenáno zhoršení parametru OS oproti kontrolní skupině (HR 1,36; 90% CI 0,79-2,34).17 Studie PACIFIC byla primárně definována pro léčbu pacientů bez ohledu na expresi PD-L1, u 37 % pacientů nebyla míra exprese známa. Na základě rozhodnutí European Medicines Agency byla registrována konsolidační léčba durvalumabem pouze pro pacienty s pozitivní expresí PD-L1.18
Pozitivní výsledky studie PACIFIC vedly k navržení probíhající studie PACIFIC2 (NCT03519971), hodnotící účinek přidání durvalumabu k probíhající CRT v dávce 1 500 mg každé čtyři týdny.
DURVALUMAB V KLINICKÉ PRAXI
Léčba durvalumabem je indikována pro pacienty s NSCLC III. neoperabilního stadia s expresí PD-L1 ≥ 1 % po ukončení konkomitantní CRT. Aplikace musí být zahájena do šesti týdnů od ukončení radioterapie. V rámci studie PACIFIC dosahovali lepších výsledků v parametru OS pacienti, u kterých byla léčba zahájena již do 14 dnů od ukončení radioterapie.17 Před zahájením je nutné vyloučit progresi onemocnění v průběhu léčby CRT, např. vyšetřením výpočetní tomografií. V České republice je očekávána plná úhrada této indikace k 1. 1. 2021.
Durvalumab je dodáván jako čirý až opalizující roztok, bezbarvý až světle žlutý koncentrát pro infuzní roztok. Jeden ml koncentrátu obsahuje 50 mg durvalumabu. Je dostupný v baleních 120 mg a 500 mg. Aktuálně je doporučené dávkování 10 mg/kg v samostatné intravenózní infuzi trvající 60 minut jedenkrát za dva týdny až do progrese onemocnění nebo do nepřijatelné toxicity nebo maximálně po dobu 12 měsíců.18 V nových klinických studiích, jako např. PACIFIC 2, se osvědčila jednotná aplikace durvalumabu v dávce 1 500 mg každé čtyři týdny. Food and Drug Administration schválila alternativní dávkování v listopadu 2020, v České republice bude standardně k dispozici v průběhu roku 2021.19
BEZPEČNOST DURVALUMABU
Léčba durvalumabem může být spojena především s imunitně podmíněnými nežádoucími účinky. Je nutná jejich včasná diagnostika a léčba. Většina, včetně závažných, odezněla po zahájení vhodné léčebné intervence nebo po vysazení durvalumabu. Bezpečnost durvalumabu byla hodnocena zejména v rámci konsolidační léčby po ukončení CRT ve studii PACIFIC. Nejčastěji hlášeným nežádoucím účinkem jakéhokoli stupně byl kašel (40,2 ve skupině s durvalumabem vs. 30,3 % v placebové skupině), infekce horních cest dýchacích (26,1 vs. 11,5 %) a vyrážka (21,7 vs. 12,0 %). Celkový výskyt nežádoucích účinků stupně 3 nebo 4 byl 12,8 % ve skupině s durvalumabem oproti 9,8 % v placebové skupině. Nejčastěji byla hlášena pneumonitida (6,5 vs. 5,6 %). Pneumonitida patří mezi nejzávažnější komplikace imunoterapie, nebyla však výrazně vyšší oproti kontrolní skupině a její četnost je třeba posuzovat v kontextu aplikované radioterapie.13
ZÁVĚR
Konsolidační léčba durvalumabem se stává součástí léčebného algoritmu inoperabilního NSCLC stadia III. Přináší první možnost konsolidační aplikace imunoterapie po aplikaci CRT a představuje referenční molekulu v této indikaci. Tolerance a bezpečnostní profil jsou příznivé, je nutná včasná diagnostika a léčba imunitně podmíněných nežádoucích účinků. Očekávají se výsledky dalších studií s durvalumabem a dalšími checkpoint inhibitory.
LITERATURA
- Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Dostupné na: https://www.svod.cz/
- Aupérin A, Le Péchoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol 2010;28:2181-2190.
- Buchbinder EI, Desai A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition. Am J Clin Oncol 2016;39:98-106.
- Stewart R, Morrow M, Hammond SA, et al. Identification and characterization of MEDI4736, an antagonistic anti-PD-L1 monoclonal antibody. Cancer Immunol Res 2015;3:1052-1062.
- Lee HT, Lee JY, Lim H, et al. Molecular mechanism of PD-1/PD-L1 blockade via anti-PD-L1 antibodies atezolizumab and durvalumab. Sci Rep 2017;7:5532.
- Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift. J Natl Cancer Inst 2013;105:256-265.
- Bílek O, Bohovicová L, Demlová R, et al. Nemalobuněčný karcinom plic - od imunobiologie k imunoterapii [Non-small cell lung cancer - from immunobiology to immunotherapy]. Klin Onkol 2016;29(Suppl 4):78-87.
- Golden EB, Pellicciotta I, Demaria S, et al. The convergence of radiation and immunogenic cell death signaling pathways. Front Oncol 2012;2:88.
- Demaria S, Ng B, Devitt ML, et al. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated. Int J Radiat Oncol Biol Phys 2004;58:862-870.
- Antonia SJ, Brahmer JR, Khleif S, et al. Phase 1/2 study of the safety and clinical activity of durvalumab in patients with non-small cell lung cancer (NSCLC). Ann Oncol 2016;27(Suppl 6).
- Garassino MC, Cho B-C, Kim J-H, et al. Durvalumab as third-line or later treatment for advanced non-small-cell lung cancer (ATLANTIC): an open-label, single-arm, phase 2 study. Lancet Oncol 2018;19:521-536.
- Planchard D, Popat S, Kerr K, et al. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019;30:863-870.
- Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017;377:1919-1929.
- Faivre-Finn C, Vicente D, Kurata T, et al. LBA49 - Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase III PACIFIC trial. Ann Oncol 2020;31:S1178-S1179.
- Gray JE, Villegas A, Daniel D, et al. Three-year overall survival with durvalumab after chemoradiotherapy in stage III NSCLC-update from PACIFIC. J Thorac Oncol 2020;15:288-293.
- Faivre-Finn C, Spigel DR, Senan S, et al. 1363O Efficacy and safety evaluation based on time from completion of radiotherapy to randomization with durvalumab or placebo in pts from PACIFIC. Ann Oncol 2018;29(Suppl 8):488.
- Antonia SJ, Villegas A, Daniel D, et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med 2018;379:2342-2350.
- European Medical Agency. Summary of product characteristics IMFINZI [online]. Dostupné na: https://www.ema.europa.eu/ en/medicines/human/EPAR/imfinzi
- Slater H; Cancer Network. FDA approves additional dosing option of durvalumab for stage III NSCLC, advanced bladder cancer [online]. Dostupné na: https://www.cancernetwork.com/view/fda-approves-additional-dosing-optionof-durvalumab-for-stage-iii-nsclcadvanced-bladder-cancer (November 20, 2020)