Postavení konkomitantní chemoradioterapie v léčbě nemalobuněčného karcinomu plic
01/2021
MUDr. Jaromír Roubec, Ph.D.; MUDr. Jaromír Richter
Komplexní onkologické centrum, Nemocnice Nový Jičín
SOUHRN
V přehledu diskutují autoři aktuální přístupy v léčbě lokálně pokročilého nemalobuněčného karcinomu plic s použitím konkomitantní chemoradioterapie vycházející z předchozích výsledků a metaanalýz a nové možnosti léčby kombinované chemoradioterapie s imunoterapií.
Klíčová slova
NSCLC, konkomitantní chemoradioterapie, inhibitory kontrolních bodů
SUMMARY
In the overview the authors discuss the actual approaches in the concomitant chemoradiotherapy based on the previous results and meta-analysis and discuss the new possibilities in the combined chemoradiotherapy and immunotherapy of the locoregional advanced non-small cell lung cancer.
Key words
NSCLC, concomitant chemoradiotherapy, checkpoint inhibitors
ÚVOD
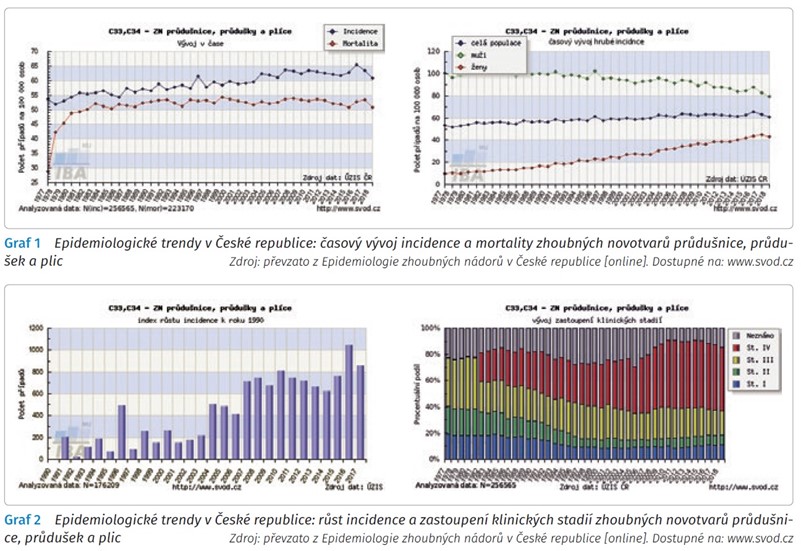
Epidemiologické trendy, růst incidence, zastoupení jednotlivých stadií nemalobuněčného karcinomu plic (non-small cell lung cancer, NSCLC) a pětileté přežití jsou stále důvodem ke snaze zlepšit životní prognózu nemocných ve vyšších stadiích nemoci (graf 1 a 2).
Radioterapeutické postupy léčby stejně jako chemoterapie samotná jsou k dnešnímu dni dobře popsané onkologické metody léčby bronchogenního karcinomu a jsou zatím v systému léčby její nezastupitelnou součástí. Uplatňují se j ak v kurativních, tak paliativních přístupech. Stále diskutovanou a na různých pracovištích různou měrou používanou metodou je jejich konkomitantní užití, a to u malobuněčného karcinomu plic (small cell lung cancer, SCLC) i u NSCLC. Zatímco u SCLC je chemoradioterapie v limitovaném stadiu nemoci častějším přístupem, kdy konkomitantní chemoradioterapie by měla být zařazena do léčebného algoritmu ideálně od 2. cyklu chemoterapie v režimu carboplatina/cisplatina + etoposid a měla by být standardem léčby, tak u NSCLC je v jeho pokročilém lokoregionálním stadiu III z důvodu stále diskutovaných kontroverzí a dalších příčin užívána méně.
KONKOMITANTNÍ CHEMORADIOTERAPIE U NSCLC STADIA III
Při zvažování konkomitantní chemoradioterapie musíme zvážit faktory na straně pacienta (výkonnostní stav [performance status, PS], komorbidity, hmotnostní úbytek), faktory na straně samotné nemoci (histologie nádoru, přítomnost a typ genetické mutace a heterogenitu nádoru) a další rizika (velikost primárního nádoru a jeho lokaci, rozsah postižení uzlin a plicní a srdeční funkce, vliv pohybu při dýchání, vzdálenost nádoru od jícnu a míchy).
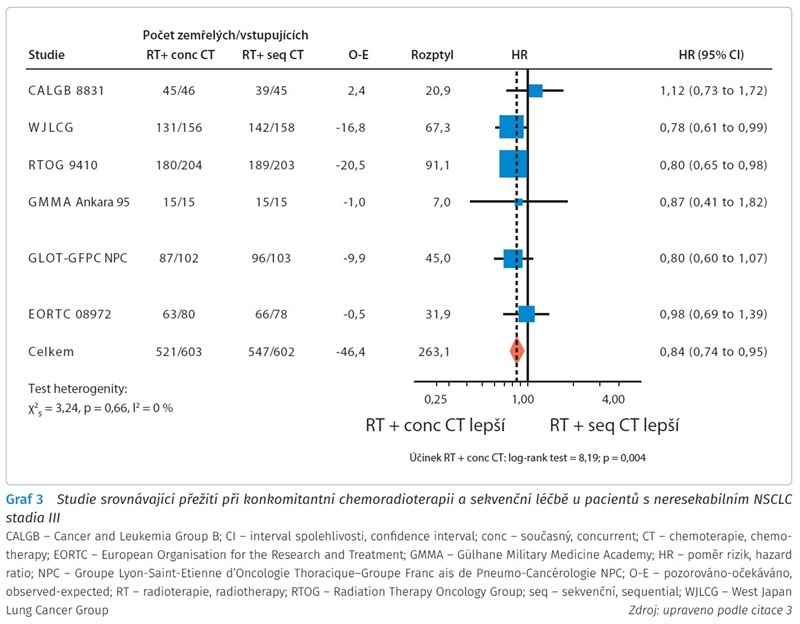
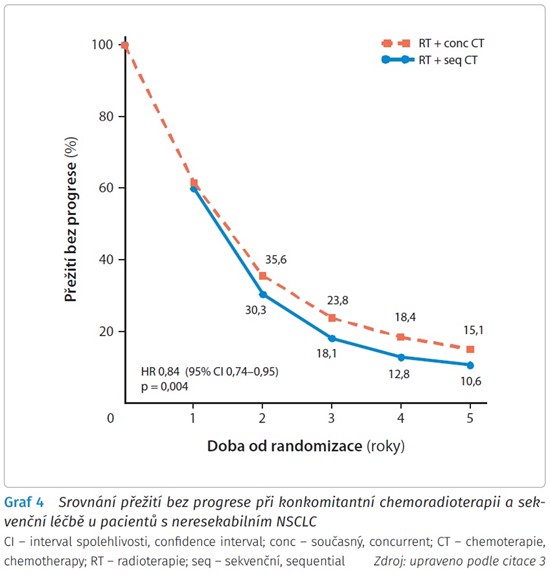
Následující metaanalýzy potvrdily přínos konkomitantní chemoradioterapie z hlediska přežití u pacientů s NSCLC stadia III. Konkomitantní chemoradioterapie znamená větší klinický přínos než sekvenční léčba, studie však za posledních 10 let nedokázaly modifikovat ani zlepšit konkomitantní chemoradioterapii jako standard péče u pacientů s neresekabilním NSCLC stadia III (graf 3 a 4).
Nejčastějšími chemoterapeutiky potencujícími účinek radioterapie jsou vinorelbin a platinový derivát. Jejich předvídatelné nežádoucí účinky a možnost orálního podání vinorelbinu usnadňují logistiku konkomitantní chemoradioterapie. Dobře snášeným režimem jsou čtyři cykly carboplatiny D1 cyklu a orální vinorelbin D1 + D8.
ZAŘAZENÍ RADIOTERAPIE A CHEMORADIOTERAPIE DO LÉČEBNÉHO ALGORITMU
Neoadjuvantní radioterapie nebo neoadjuvantní chemoradioterapie nejsou v běžné praxi na rozdíl od léčby jiných karcinomů využívány. V klinické praxi zařazujeme do léčebného algoritmu radikální radioterapii nebo chemoradioterapii především u pacientů nevhodných k chirurgické intervenci.
Standardně je využívána - podle pooperačního stagingu a gradingu - adjuvantní radioterapie, po předchozím podání adjuvantní chemoterapie, kdy bylo potvrzeno delší přežití u pacientů s onemocněním ve stadiu III, N2; u pacientů nevhodných k systémové léčbě lze zvolit paliativní radioterapii nebo v přísně indikovaných případech využít samostatnou intrabronchiální aplikaci - brachyradioterapii (BRT).
U vybraných pacientů a vhodně uložených tumorů do velikosti 4 cm lze využít metodu stereotaktické radioterapie (stereotactic body radiotherapy, SBRT). Tato speciální metoda zevní radioterapie je v hodnocení tříletého přežití pacientů bez recidivy srovnatelná s chirurgickým výkonem. Výhodou SBRT je použití nízkého počtu, zpravidla 3-10 frakcí, s ozářením ložiska vysokou ložiskovou dávkou s prudkým spádovým gradientem dávky v okolí.
DEFINICE CÍLOVÝCH OBJEMŮ RADIOTERAPIE PODLE MEZINÁRODNÍCH DOPORUČENÍ
Cílové objemy pro tři druhy techniky 3D, tj. klasickou konformní radioterapii (conformal radiotherapy, CRT), radioterapii s modulovanou intenzitou (intensity modulated radiotherapy, IMRT) a obrazem navigovanou radioterapii (image guided radiotherapy, IGRT), jsou určeny tumorózně postiženou oblastí. Jedná se o samotné tumorózní ložisko a postiženou spádovou oblast lymfatických uzlin. Cílové objemy ani jejich rozsah se neliší při plánování samostatné radioterapie nebo chemoradioterapie.
Konturace zakresluje okraje těchto ložisek a v případě plicních karcinomů ideálně v rozsahu pohybu při dýchacích exkurzích s využitím 4D výpočetní tomografie (computed tomography, CT) s možností prostorového zachycení pohybu ve všech směrech v makroskopickém obraze. Primárně je specifikován nádorový objem (gross tumor volume, GTV) - objem primárního nádoru (gross tumor volume - tumor, GTV-T) a objem postižených uzlin (gross tumor volume - nodes, GTV-N).
Dále je nutno určit klinický cílový objem (clinical target volume, CTV), který je tvořen objemem GTV s částí okolních struktur s předpokládaným mikroskopickým šířením. Zakreslením interního cílového objemu (internal target volume, ITV) získáváme objem, který zachycuje všechny pohyby CTV. Na ITV objem navazuje plánovaný cílový objem (planning target volume, PTV) / expanze objemu, která bere v úvahu určitou nepřesnost při nastavení pacienta (set up margin) a určuje se podle zvolených technik, minimálně bývá kolem 5 mm.
- Plánování radioterapie - cílové objemy - GTV:
- verifikace: plánovací CT, ideálně PET/CT, 4D CT;
- GTV-T: makroskopicky detekovatelný tumor;
- GTV-N: PET/CT pozitivní lymfatické uzliny.
- Plánování radioterapie - cílové objemy - CTV:
- CTV-T: lem kolem primárního tumoru;
- GTV-T: lze použít uniformní lem 5 mm, optimálně pro spinocelulární karcinom lem 6 mm, adenokarcinomy 8 mm, vhodná korekce kolem rizikových struktur;
- CTV-N: lem kolem GTV-N 8 mm, elektivní ozáření nepostižených oblastí se v současné době nedoporučuje.
- Plánování radioterapie - cílové objemy - PTV:
- uniformní lem pro dýchací exkurze není vždy optimální, při plánování 4D CT je nutno zohlednit pohyb ložiska; » je možno využít koncepty maximum intensity projection (MIP), mid-ventilation (Mid-V), mid-position (Mid-P);
- ITV - jde o nejčastěji používaný koncept - tj. zachycení všech pozic tumoru při dechových fázích na 4D CT;
- PTV zahrnuje lem 5 mm nebo lze volit individuální lem.
Samostatná radioterapie při ozařování lokoregionálně pokročilých tumorů plic nemá většinou kurativní účinek. Použitím konkomitantní chemoradioterapie nebo sekvenční chemoradioterapie bylo dosaženo výrazně lepších léčebných výsledků s potvrzením superiority při využití konkomitantní chemoradioterapie.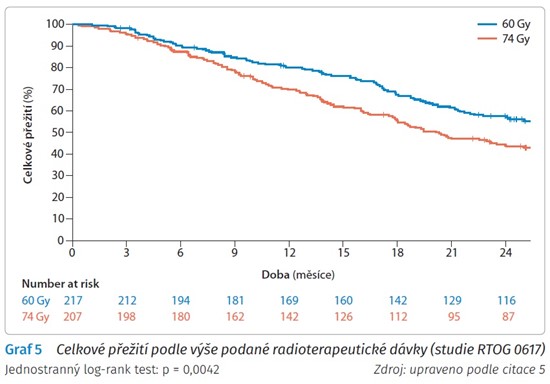
Většina režimů chemoterapie při chemoradioterapii je na bázi platinových derivátů kombinaci s taxany, vinorelbinem, paclitaxelem nebo u plicních adenokarcinomů využívají platinového derivátu s pemetrexedem pro nižší toxicitu.
Diskuse se vedou o výši podané radioterapeutické dávky (RTOG 0617) (graf 5).
Při navýšení dávky radioterapie nebo radioterapie s konkomitantní chemoterapií u nádorů hlavy a krku byl potvrzen vyšší účinek léčby s delším mediánem přežití pacientů. Stejný efekt byl očekáván u plicních NSCLC nádorů, především u spinocelulárních tumorů.
Pacienti s NSCLC stadia III s konkomitantní radioterapií/chemoradioterapií s weekly podáváním CBCDA + paclitaxelu s následnými dvěma cykly konsolidační chemoterapie byli randomizováni do dvou ramen s podáváním radioterapie v dávkách 60 Gy a 74 Gy.
Studie překvapivě ukázala vyšší počet úmrtí v rameni s dávkou radioterapie 74 Gy oproti radioterapii v rameni s dávkou radioterapie 60 Gy.
Zároveň medián celkového přežití byl 28,7 měsíce v rameni s dávkou 60 Gy oproti mediánu přežití 19,8 měsíce v rameni s dávkou 74 Gy.
Konkomitantním postupem bylo dosaženo lepší lokoregionální kontroly nemoci oproti sekvenčnímu postupu, systémová kontrola nemoci je v obou případech srovnatelná.
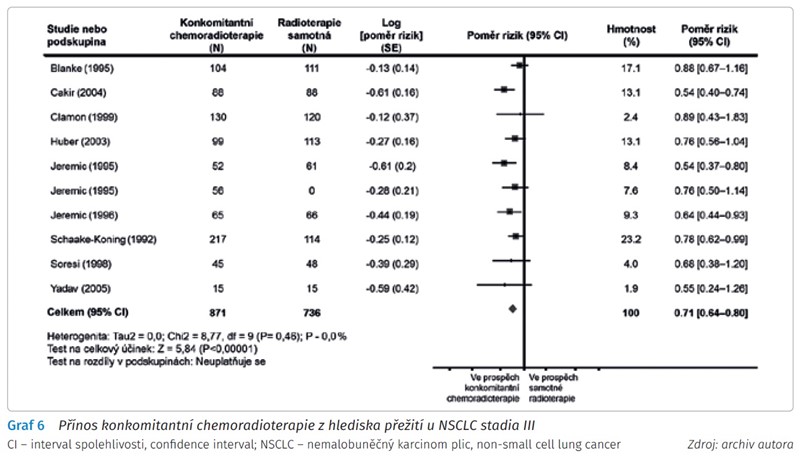
Metaanalýzy potvrdily přínos konkomitantní chemoradioterapie z hlediska přežití u NSCLC stadia III (graf 6).
Zaznamenána byla mírně zvýšená toxicita při konkomitantní chemoradioterapii ve srovnání se sekvenční chemoradioterapií ve formě akutní ezofagitidy (graf 7).
Nadějnou kombinací konkomitantní chemoradioterapie je následná udržovací léčba checkpoint inhibitorem durvalumabem, naposledy doložená klinickou studií PACIFIC, kde byli randomizováni pacienti s lokálně pokročilým, neresekabilním NSCLC stadia III, u nichž nedošlo k progresi po definitivní souběžné chemoradioterapii na bázi platiny (≥ 2 cykly chemoterapie konkomitantně s radioterapií). Durvalumab byl podáván v dávce 10 mg/kg jednou za dva týdny (every 2 weeks, Q2W) po dobu maximálně 12 měsíců oproti placebu, kde letos aktualizované čtyřleté celkové přežití (overall survival, OS) v populaci podle léčebného záměru (intention to treat population, ITT) u pacientů s durvalumabem dosáhlo mediánu (95% interval spolehlivosti [confidence interval, CI]) 47,5 (38,4-52,6) měsíce oproti 29,1 (22,1-35,1) měsíce, a to bez významného rozdílu v parametrech bezpečnosti (graf 8).
ZÁVĚR
Neresekabilní lokálně pokročilý NSCLC stadia III je spojen se špatnou prognózou. Výsledky metaanalýz naznačují větší přínos konkomitantní chemoradioterapie oproti sekvenční léčbě.
Navzdory početným studiím zkoumajícím modifikace léčebných režimů zůstává způsob léčby u neresekabilního lokálně pokročilého NSCLC beze změny již déle než 10 let.
Studie PACIFIC byla první studie, která hodnotila imunomodulační terapii u neresekabilního lokálně pokročilého NSCLC stadia III.
LITERATURA
- Ahn JS, Ahn YC, Kim JH, et al. Multinational randomized phase III trial with or without consolidation chemotherapy using docetaxel and cisplatin after concurrent chemoradiation in inoperable stage III non-small-cell lung cancer: KCSG-LU05-04. J Clin Oncol 2015;33:2660-2666.
- Antonia SJ, Villegas A, Daniel D, et al.; PACIFIC Investigators. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Eng J Med 2018;379:2342-2350.
- Aupérin A, Le Péchoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol 2010;28:2181-2190.
- Ball D, Mai GT, Vinot S, et al.; TROG 09.02 CHISEL investigators. Stereotactic ablative radiotherapy versus standard radiotherapy in stage I NSCLC /TROG 09.02 CHISEL/ a phase 3, open label, randomised controlled trial. Lancet Oncol 2019;20:494-503.
- Bradley J, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 2015;16:187-199.
- Faivre-Finn C, Vicente D, Kurata T, et al. Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase III PACIFIC trial. Ann Oncol 2020;31(suppl 4):S1142-S1215.
- Hanna N. Current standards and clinical trials in systemic therapy for stage III lung cancer: what is new? Am Soc Clin Oncol Educ Book 2015:e442-e447.
- Jeremic B, Shibamoto Y, Acimovic L, Djuric L. Randomized trial of hyperfractionated radiation therapy with or without concurrent chemotherapy for stage III non-small-cell lung cancer. J Clin Oncol 1995;15:452-458.
- Jeremic B, Shibamoto Y, Acimovic L, Milisavljevic S. Hyperfractionated radiation therapy with or without concurrent low-dose daily carboplatin/etoposide for stage III non-small-cell lung cancer: A randomized study. J Clin Oncol 1996;14:1065-1070.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology for Non-Small Cell Lung Cancer V.1.2018 [online]. Dostupné na: www.nccn.org
- O’Rourke N, Roqué I Figuls M, Farré Bernadó N, Macbeth F. Concurrent chemoradiotherapy in non-small cell lung cancer. Cochrane Database Syst Rev 2010;16:CD002140.
- Schaake-Koning C, van den Bogaert W, Dalesio O, et al. Effects of concomitant cisplatin and radiotherapy on inoperable non-small-cell lung cancer. N Engl J Med 1992;326:524-530.
- Senan S, Brade A, Wang LH, et al. PROCLAIM: Randomized phase III trial of pemetrexed-cisplatin or etoposidcisplatin plus thoracic radiation therapy followed by consolidation chemotherapy in locally advanced NSCLC. J Clin Oncol 016;34:953-962.
- Str0m HH, Bremnes RM, Sundstr0m SH, et al. Concurrent palliative chemoradiation leads to survival and quality of life benefits in poor prognosis stage III non-small-cell lung cancer: a randomised trial by the Norwegian Lung Cancer Study Group. Br J Cancer 2013;109:1467-1475.
- Zatloukal P, Petruzelka L, Zemanova M, et al. Concurrent versus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced non-small cell lung cancer: a randomized study. Lung Cancer 2004;46:87-98.