Receptor epidermálního růstového faktoru – jeho význam, diagnostika a vývoj léčby u nemalobuněčného karcinomu plic
01/2021
MUDr. Lenka Jakubíková, Ph.D.
Klinika nemocí plicních a tuberkulózy LF UK a FN Brno
SOUHRN
Receptor epidermálního růstového faktoru (epidermal growth factor receptor, EGFR) je transmembránový glykoprotein s vazebným místem pro rodinu ligandů extracelulárních proteinových epidermálních růstových faktorů. Receptor epidermálního růstového faktoru je členem rodiny receptorů ErbB (erythroblastic leukemia viral oncogene), která je tvořena celkem čtyřmi členy úzce příbuzných receptorových tyrosinkináz: EGFR (ErbBI, HER1), ErbB2/neu (HER2), ErbB3 (HER3) a ErbB4 (HER4). Epidermální růstový faktor a jeho receptor byly objeveny Stanleyem Cohenem. Cohen se v roce 1986 podělil o Nobelovu cenu za medicínu s Ritou Levi-Montalciniovou za objev růstových faktorů. Od EGFR může být signál předáván řadou intracelulárních přenašečů RAS-RAF-MAPK (vedoucí k proliferaci buněk), nebo jsou aktivovány signální dráhy JAK-STAT3 či PI3K-AKT (ovlivňující přežívání buněk). Vyšetření mutačního stavu tohoto receptoru má zásadní roli v rozhodování o léčbě nemalobuněčného plicního karcinomu a je cílem tzv. biologické léčby.
Klíčová slova
EGFR, NSCLC, osimertinib, afatinib
SUMMARY
The epidermal growth factor receptor (EGFR) is a transmembrane glycoprotein with a binding site for a family of extracellular protein epidermal growth factor ligands. The epidermal growth factor receptor is a member of the ErbB (erythroblastic leukemia viral oncogene) receptor family, which consists of a total of four members of closely related receptor tyrosine kinases: EGFR (ErbBI or HER1), ErbB2/neu (HER2), ErbB3 (HER3) and ErbB4 (HER4). Epidermal growth factor and its receptor were discovered by Stanley Cohen. In 1986, Cohen shared the Nobel Prize in Medicine with Rita Levi-Montalcini for his discovery of growth factors. The signal from EGFR can be transmitted by a number of intracellular transporters RAS-RAF-MAPK (leading to cell proliferation), or the singular pathways JAK-STAT3 or PI3K-AKT (affecting cell survival) are activated. Examination of the mutational status of this receptor plays a crucial role in deciding on the treatment of non-small cell lung cancer and is the goal of so-called biological treatment.
Key words
EGFR, NSCLC, osimertinib, afatinib
ÚVOD
Růstové faktory jsou nezbytné pro vývoj, růst a homeostázu mnohobuněčných organismů. Působí prostřednictvím receptorů buněčného povrchu; růstové faktory jsou vyžadovány pro komunikaci mezi buňkami, které jsou základem indukce embryonální tkáně, stanovení vývoje, přežití buněk, apoptózy, diferenciace tkání a buněčné migrace.
FUNKCE EGFR
Receptory růstového faktoru přenášejí extracelulární signály prostřednictvím aktivace intracelulárních poslů nebo přímo prostřednictvím translokace receptoru do jádra. Dvojení genů a funkční specializace umožnily této skupině receptorů převzít různé funkce ve vývoji a udržování specifických typů tkání. Selektivita signálu, zesílení signálu a regulace receptoru jsou zesíleny jedinečnými strukturálními prvky jednotlivých členů rodiny EGFR, provázaných společnou základní strukturou. Kombinatorické účinky také zvyšují rozmanitost signálů prostřednictvím různých dimerizačních partnerů a časově prostorově omezené exprese proteinu. Mnoho ligandů rodiny EGFR má během vývoje redundantní i neredundantní funkce, což dále zvyšuje tyto kombinatorické účinky. Kromě toho transaktivace receptorů rodiny epidermálního růstového faktoru (epidermal growth factor, EGF) nezávislá na ligandu přidává ještě další vrstvu signální složitosti, protože receptory a intracelulární dráhy jsou rekrutovány pro použití jinými signálními cestami, jako jsou G protein, Wnt, integrin a další dráhy růstového faktoru. Rodina epidermálních růstových faktorů jsou strukturně příbuzné receptory, jedná se o transmembránové glykoproteiny s jedním řetězcem sestávající z ektodomény vázající extracelulární ligand, z transmembránové domény, krátkého juxtamembránového řezu, domény tyrosinkinázy a C-terminálního konce obsahujícího tyrosin. Vazba rozpustného ligandu na ektodoménu receptoru podporuje homoa heterodimerní tvorbu mezi receptory. Dimerizace receptoru je nezbytná pro aktivaci intracelulární domény tyrosinkinázy a fosforylaci C-terminálního konce. Fosfotyrosinové zbytky pak aktivují buď přímo, nebo prostřednictvím adaptačních proteinů složky kaskády signálních drah, včetně cest RAS/MAPK, PLCyl/KC, PI3 kinázy/AKT a STAT. Receptor epidermálního růstového faktoru a ErbB4 lze považovat za plně funkční receptory se schopností vázat i ligandy a autofosforylovat C-terminální konce prostřednictvím funkčních intracelulárních tyrosinkinázových domén. ErbB2 je však jedinečný v tom, že nemá žádný známý ligand, ale je výhodným dimerizačním partnerem pro jiné EGFR. ErbB3 je odlišný, protože nemá vnitřní aktivitu tyrosinkinázy, ale může přenášet signály prostřednictvím interakce s aktivními receptory kinázy, jmenovitě EGFR, ErbB2 a ErbB4. Ačkoli všechny receptory ErbB byly lokalizovány v jádru, ErbB4 je schopen přímého přenosu extracelulárních signálů do jádra prostřednictvím uvolnění intracelulární domény ligandu závislého na štěpení receptoru duální proteázou. Expanze počtu a specializace ErbB receptorů během evoluce byla paralelní diferenciální vazbou receptorů na specifické podmnožiny ligandů. Ligandy ErbB začínají jako proteiny ukotvené na buněčné membráně, které jsou proteolyticky zpracovávány za uvolňování rozpustných molekul. Specifičnost ligandu, redundance, zpracování a variabilní vzorce tkáňové exprese zvyšují signální rozmanitost dráhy EGF. Epidermální růstový faktor transformující růstový faktor alfa (transforming growth factor alpha, TGF-α) a amfiregulin se jedinečně vážou s EGFR. ErbB3 váže neuregulin-l a neuregulin-2 a jedinečně váže neuroglykan C. ErbB4 je také schopen vázat neuregulin-1 a neuregulin-2 a jedinečně se váže také na neuregulin-3, neuregulin-4 a tomoregulin. Receptor epidermálního růstového faktoru i ErbB4 vážou heparin vázající EGF podobný růstový faktor (heparin-binding EGF, HB-EGF), betacellulin, epiregulin a epigen.
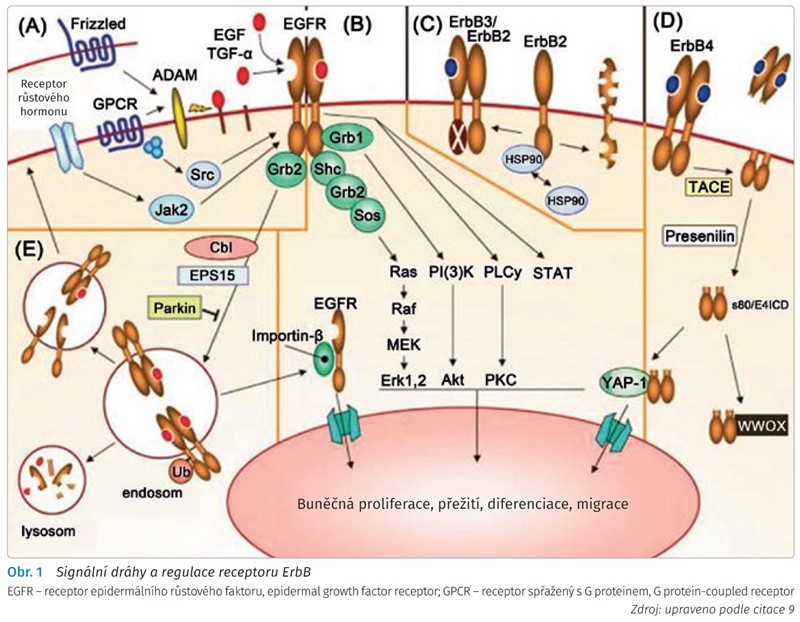
Na obr. 1 jsou zachyceny signální dráhy a regulace receptoru ErbB:
Aktivace receptoru. K aktivaci ErbB receptorů ligandem dochází prostřednictvím parakrinních a autokrinních mechanismů. Ligandy jsou vázány na membránu až do zpracování pomocí metaloproteináz rodiny ADAM. K stimulaci ADAM metaloproteinázové aktivity může dojít aktivací Frizzled pomocí Wntl nebo Wnt5a nebo aktivací receptorů spojených s G proteinem ligandy, jako je trombin, endotelin a kyselina lysofosfatidová. Alternativně aktivace receptoru spojeného s G proteinem aktivuje rozpustnou tyrosinkinázu Src, která může fosforylovat EGFR. Aktivace receptorů růstového hormonu aktivuje Janusovu tyrosinkinázu 2 (Janus tyrosine kinase 2, JAK2), která je také schopna fosforylovat EGFR.
Převod signálu do jádra. Aktivace ErbB receptorů vede k aktivaci RAS/MAPK, PI3K/AKT, PLCy/PKC a STAT cesty. Tyrosinové fosforylované ErbB receptory vážou adaptéry, jako jsou Shc a Grb2, což vede k náboru Sos a aktivaci RAS/MAPK dráhy. EGFR vyžaduje dokovací protein Gab-1 pro aktivaci dráhy PI3K/AKT. Jiné receptory ErbB nevyžadují Gab-1. Receptory samotné se mohou také přemístit do jádra, aby ovlivnily genovou transkripci. Receptor epidermálního růstového faktoru má definovaný nukleární lokalizační signál a interaguje s importinem-p při jeho přenosu do jádra. Cytozolická část EGFR s80/E4ICD, produkt proteolytického uvolňování intracelulární tyrosinkinázy, se translokuje do jádra a ukázalo se, že přímo ovlivňuje genovou transkripci.
Regulace ErbB2 pomocí proteinu HSP90. Protein HSP90 stabilizuje ErbB2 na buněčné membráně a zabraňuje neregulované tvorbě heterodimeru s jinými ErbB, jako je např. neaktivní kináza ErbB3. HSP90 také zabraňuje degradaci ErbB2.
Sekvenční proteolýza ErbB4. Dvoustupňová proteolýza ErbB4 v extracelulární juxtamembránové oblasti pomocí TACE/ADAM17 následovaná štěpením v transmembránové doméně presenilin/γ-sekretáza uvolňuje intracelulární část ErbB4 (s80/E4ICD), která může působit jako jaderný doprovod pro molekuly, jako je YAP-1 a STAT5A. Protein WWOX obsahující WWOX sekvestruje s80/E4ICD v cytosolu.
Vazba ligandu a dimerizace EGFR stimuluje receptorovou endocytózu. E3 ubikvitin ligáza Cbl se váže na fosforylovaný EGFR, což vede k navázání ubikvitinu a lysosomálnímu zacílení. Oba ubikvitinu zbavené heterodimery EGFR a EGFR/ErbB2 bez ligandů se přednostně recyklují na buněčný povrch.
Degradace proteinů pomocí proteasomů je velice sofistikovaný proces, který se děje v rámci tzv. ubikvitin-proteasomového systému neboli tzv. ubikvitin-proteasomové cesty. Významnou roli v tomto procesu hraje malý (76 aminokyselin, 8,5 kDa) protein ubikvitin, který byl objeven už v roce 1975, aniž by byla známa jeho funkce. Již z názvu však plyne, že tento protein se hojně vyskytuje ve všech eukaryotních buňkách (je „ubikvitní“ čili „všude se vyskytující1'). Ubikvitin slouží ke značení proteinů v ději, jemuž říkáme ubikvitinace nebo ubikvitinylace proteinu. Význam, rozmanitost a komplexní kontext označování proteinů ubikvitinem dnes dosahuje úrovně dosud nejvýznamnější posttranslační modifikace proteinů, kterou je fosforylace. Ubikvitin je v buňce nejprve vázán (aktivován) za spotřeby adenosintrifosfátu (ATP) tzv. ubikvitin-aktivujícím enzymem E1. Následně je přenesen na ubikvitin-přenášející (nebo ubikvitin-konjugující) enzym E2. Další přesun ubikvitinu na protein, který má být degradován (PDG; nebo na vytvářející se řetězec ubikvitinů na PDG), je podmíněn ubikvitin-ligázou E3, jež dokáže specificky rozpoznat PDG. Enzymy E1 a E2 slouží převážně pouze k transportu ubikvitinů, naopak enzymy E3 obsluhují jejich konečné navázání na PDG, rozpoznaný právě těmito enzymy. Nejprve je tedy na PDG navázán první ubikvitin, na něj pak druhý, na druhý třetí atd. Z toho, že E3 enzymy specificky rozpoznávají různé PDG, plyne také to, že v buňkách je málo různých E1 a E2 enzymů (v lidských buňkách existují přinejmenším dva E1 enzymy), zatímco E3 enzymů existuje rozmanité množství (stovky) pro různé skupiny proteinů, určených k degradaci.
Členové rodiny EGFR aktivují RAS/MAPK, PI3K/AKT, PLCy1/PKC, STAT a atypické dráhy PKC. Fosforylace tyrosinu na EGFR vytváří vazebná místa pro homologii 2 Grb2 a Src (Shc2), která aktivují RAS/RAF/MAPK cestu. Jiné receptory ErbB také aktivují dráhu RAS/MAPK. PI3K/AKT cesta je důležitá pro přežití buněk. K aktivaci této dráhy na vysoké úrovni přímou vazbou podjednotky p85 PI3K na aktivovaný receptor dochází u ErbB3 a ErbB4, protože tyto receptory obsahují vazebná místa p85. Receptor epidermálního růstového faktoru může také slabě aktivovat cestu PI3K prostřednictvím adaptorového proteinu Gab-1. Receptor epidermálního růstového faktoru je také schopen aktivovat PLCy, což vede k aktivaci proteinkinázy C následované aktivací c-Jun a MAPK, regulující proliferaci buněk. STAT3 hraje důležitou roli při udržování polarity a adheze epiteliálních buněk. Vazba STAT3 na aktivovaný EGFR vede k dimerizaci a translokaci STAT3 do jádra za účelem regulace genové transkripce. Podobně se STAT5 může vázat na EGFR i ErbB4. Komplex Par6-Par3-atypických PKC je důležitý v epiteliální organizaci. Komplex interaguje s aktivovaným ErbB2, což způsobuje disociaci Par3 od komplexu a vede ke ztrátě apikální bazální polarity. Buňky aktivované tímto způsobem také vykazují zvýšenou proliferaci a přežívání. Kromě signalizace z buněčné membrány se mohou členové rodiny ErbB pohybovat přímo do jádra a ovlivňovat transkripci genu.
VÝZNAM RODINY EGFR V EMBRYOGENEZI A VÝVOJI SAVCŮ
Myši s defekty v rodině ErbB receptorů vykazují širokou škálu poruch fenotypů odpovídající defektům receptorů hrajících roli v buněčné diferenciaci, proliferaci, migraci a přežití. Velká variabilita fenotypů myší s deficitem EGFR v různých genetických podmínkách zdůrazňuje množství redundance a regulace v tomto systému. Myši s nedostatkem EGFR umírají do tří týdnů postnatálně v závislosti na genetickém pozadí a vykazují defekty v buněčné proliferaci, diferenciaci a migraci v široké škále tkání, včetně kůže, centrálního nervového systému, střev, plic, jater, ledvin, placenty a patra. U kmenů s deficitem EGFR dochází postnatálně k neurodegeneraci ve frontálním kortexu, čichových cibulkách a thalamu také na kmeni. ErbB2 je společným a nejčastěji využívaným receptorem ostatních členů rodiny ErbB. ErbB2 hraje roli při tvorbě a správné funkci komorového myokardu. Myši postrádající ErbB2 umírají v polovině gravidity pravděpodobně kvůli selhání tvorby myokardu. Podmíněné odstranění ErbB2 v komorovém srdečním svalu myší vede k postnatální dilatační kardiomyopatii a smrti. Navíc myši s deficitem ErbB2 vykazují defekty v mozkových senzorických gangliích, pravděpodobně způsobené poškozeními v nervovém systému. ErbB2 hraje roli v terminální diferenciaci prekurzorů oligodendrocytů na zralé oligodendrocyty v míše a také v myelinizaci periferních nervů Schwannovými buňkami. Záchrana embryonálních letálních srdečních defektů myší s deficitem ErbB2 expresí divokého typu ErbB2 s myokardem vede k myším se závažnými defekty migrace Schwannových buněk v periferním nervovém systému se ztrátou senzorických a motorických neuronů. Myši s odstraněným ErbB3 vykazují defektní tvorbu atrioventrikulárních chlopní, což vede k hluboké chlopenní regurgitaci pravděpodobně přispívající k smrti embrya. U myší s nulovou hodnotou ErbB3 se také vyvinou neuropatie z defektní myelinizace periferních nervů v důsledku nedostatku prekurzorů Schwannových buněk, a tedy zralých Schwannových buněk. Navíc mají defekty v tvorbě mozečku a ganglií mozkových nervů. Podobně jako u myší s chybějícím ErbB2 umírají myši s deficitem ErbB4 uprostřed gestace se selháním trabekulace komorového myokardu. Rovněž podmíněné narušení exprese ErbB4 v komorovém myokardu vede k dilatační kardiomyopatii. Myši postrádající ligandy EGFR vykazují mnohem méně závažných fenotypů než mutantní myši EGFR, což demonstruje vysoký stupeň redundance zabudované do signalizace EGFR. Myši postrádající EGF, TGF-α a nebo amfiregulin selhávají v rekapitulaci celého rozsahu fenotypů vyřazených z EGFR. Myši bez EGF a amfiregulinů nemají snadno identifikovatelný fenotyp. Mutace TGF-α u myší vedou k defektům ve vlasovém folikulu a vývoji očí. Podobně jako u myší s nulovou hodnotou EGFR vykazují TGF-α defektní myši také sníženou proliferaci předních mozkových neurálních progenitorových buněk, ačkoli se to u zjevného fenotypu chování u myší neprojevuje. Samice myší s kombinovaným deficitem amfiregulinu, EGF a TGF-α vykazují snížený vývoj duktální části mléčné žlázy během puberty se závažnými defekty v moči a laktogenezi. Mutantní myši s trojitým deficitem EGF, TGF-α a amfiregulinu vykazují sníženou proliferaci buněk ve střevu, což vede ke snížené produkci mucinu. Na rozdíl od zjevné redundance v signalizaci ligandu prostřednictvím EGFR se zdá, že role ErbB receptorů a ligandů ve vývoji srdce má menší redundanci. Neuregulin-1 váže ErbB3 i ErbB4. ErbB3 a ErbB4 se účastní ErbB2 na aktivaci kaskádové signalizace. Na rozdíl od výše uvedených ligandů EGFR vede cílené narušení neuregulinu-1 k selhání srdeční trabekuce a defektů polštářů srdce, které těsně rekapitulují fenotypy mutant ErbB2 a ErbB4. Neuregulin-1 je exprimován v endokardu a zdá se, že působí parakrinně prostřednictvím ErbB2 a ErbB4 s omezením myokardu, aby stimuloval tvorbu trabekulů myokardu. Neuregulin-1 deficientní myši mají také deficientní tvorbu Schwannových buněk a lebečních ganglií, podobnou těm, které byly pozorovány u mutantních myší ErbB2 a ErbB3. Obdobně delece HB-EGF, ligandu pro EGFR i ErbB4, vede k dilatační kardiomyopatii, podobné jako u mutantních myší, kterým chybí ErbB2 nebo ErbB4 v komorovém myokardu. Srdeční fenotypie myší s mutantem neuregulinem-1 a HB-EGF s jejich mutanty příbuzného receptoru ukazuje, že ačkoli ErbB signalizace v některých procesech používala redundanci ligandu, došlo také k omezenému párování ligand-receptor, aby se usnadnila specifikace definovaných tkání během vývoje savců. Neuregulin-1 je zřejmě spojen s mozkovými kortikálními chorobami - Alzheimerovou chorobou a schizofrenií. V mozcích pacientů s Alzheimerovou chorobou je neuregulin-1 v n euritických placích zvýšeně regulován, což naznačuje roli ErbB signalizace v nemoci. K akumulaci nezpracovaného neuregulinu-1 a defektní myelinizaci dochází v buňkách postrádajících enzym 1 štěpící β-amyloid (β-site amyloid precursor protein-cleaving enzyme 1, BACE1), což je enzym považovaný za důležitý v patofyziologii Alzheimerovy choroby. Polymorfismy v genu pro lidský neuregulin-1 jsou také spojovány s psychotickými rysy v některých rodinách s Alzheimerovou chorobou s pozdním nástupem. Podobně se signalizace neuregulin-1-ErbB4 podílí na patogenezi schizofrenie na základě asociace mezi polymorfismy neuregulinu-1 a nemocí v některých populacích. Na podporu této genetické asociace je pozorována zvýšená signalizace ErbB4 závislá na neuregulinu-1 v prefrontální kůře schizofrenického mozku, která je spojena se sníženou aktivitou receptoru NMDA, což pravděpodobně přispívá k patogenezi schizofrenie. Aberantní signalizace prostřednictvím rodiny receptorů EGF se podílí na mnoha lidských onemocněních. Psoriáza může být částečně řízena neregulovanou aktivací EGFR v souladu s její aberantní expresí v mezifolikulární epidermis psoriatických lézí. Myší modely také podporují tuto hypotézu u ztenčené epidermis u myší postrádajících EGFR a psoriasiformních lézí u myší postrádajících inhibitor EGFR LRIG-1. Bakterie Mycobacterium leprae se může vázat přímo na ErbB2 a aktivovat signalizaci receptoru a MAPK nezávisle na dimerizaci s jinými ErbB receptory. Aktivace receptoru vede k demyelinizaci nervů a lze očekávat, že povede k periferním neuropatiím charakteristickým pro malomocenství.
PATOLOGIE EGFR A JEHO VÝZNAM U PLICNÍHO KARCINOMU
Nadměrná exprese a mutace členů rodiny ErbB a jejich ligandů byly identifikovány u zhoubných nádorů plic, prsu, tlustého střeva, žaludku, pankreatu, vaječníků, mozku, prostaty a ledvin. Abnormální aktivace EGFR v nádorových buňkách je nejčastěji důsledkem jedné ze tří možností: zvýšená exprese proteinu, přítomnost mutací v genu EGFR nebo zmnožení kopií genu. Zvýšená tyrosinkinázová činnost EGFR vede buňku k inhibici apoptózy, zvýšené proliferaci, angiogenezi a indukuje proces metastazování. U většiny pacientů s plicním adenokarcinomem (cca 70 %) byla detekována zvýšená exprese proteinu EGFR. Dále byly pozorovány bodové mutace v tyrosinkinázové doméně genu EGFR (exony 18 a 21) s frekvencí 10 % pro bělošskou populaci, okolo 30 % pro populaci asijskou. Naopak pacienti s malobuněčným plicním karcinomem exprimují nízkou koncentraci EGFR či pod hranicí detekovatelnosti, stejně tak i přítomnost mutací v EGFR je u nich ojedinělá. Vyšší pravděpodobnost výskytu mutací v EGFR mají však pacienti nekuřáci či lehcí kuřáci, jejichž nádor z histologického hlediska představuje adenokarcinom nebo jeho smíšený subtyp, vyšší výskyt mutací genu pro EGFR je pozorován u žen a Asiatů. Mutace vyskytující se v oblasti tyrosinkinázové domény mezi exonem 18 a 21 genu EGFR jsou převážně bodové záměny a delece, eventuálně inzerce. V oblasti exonu 19 a 21 je soustředěno 80-90 % známých aktivačních mutací EGFR. Mezi tzv. aktivační mutace patří také bodová mutace G719X v exonu 18, bodové mutace L858R a L861Q v exonu 21 a delece v exonu 19.
ZPŮSOBY VYŠETŘENÍ EGFR
Při molekulárně genetickém vyšetření k určení mutační stavu genu pro EGFR je vyšetřena nukleová kyselina, převážně kyselina deoxyribonukleová (deoxyribonucleic acid, DNA). Vyšetřovat můžeme nádorovou tkáň z primárního tumoru nebo z jeho metastáz. Materiál získáváme odběry v průběhu bronchoskopie (klíštkové biopsie, jehlové biopsie) nebo chirurgickým odběrem. Materiál vhodný k vyšetření je možno získat také odběry pod kontrolou endobronchiálního ultrazvuku (endobronchial ultrasound, EBUS). V případě nemožnosti odběru tkáně lze použít i cytologické nátěry, které jsou získávány převážně v průběhu bronchoskopického vyšetření (kartáčkový stěr, punkce tenkou jehlou, aspirace, výplach, bronchoalveolární tekutina). Jako zdroj materiálu pro vyšetření lze použít pleurální výpotek. V případě, že u pacienta není možný odběr nádorové tkáně, lze využít i volné cirkulující nádorové nukleové kyseliny, izolované ze vzorku plazmy z periferní krve. Tyto volné cirkulující nukleové kyseliny jsou uvolňovány nádorovými buňkami přímo do krevního oběhu. Jedná se o tzv. tekutou biopsii; tato metoda je v dnešní době velmi diskutována pro svou vysokou specificitu, ale ne tak výraznou senzitivitu. Dostatek nádorové tkáně je předpokladem izolace dostatečného množství nukleových kyselin pro analýzu. Podle typu odběru bývá množství dostupného materiálu rozdílné. Limitujícím faktorem molekulárně biologického vyšetření je také podíl nádorových buněk v celkově odebrané tkáni. Malé zastoupení nádorových buněk ve vzorku může mít za následek neprůkaznost používané metody. Údaj o procentuálním zastoupení nádorových buněk ve vzorku uvádí patolog po morfologickém zhodnocení. V případě vyšetřování mutačního stavu genu pro EGFR u pacientů s NSCLC je žádoucí získat výsledek v takovém čase, aby v případě průkazu aktivačních mutací mohla být co nejdříve zahájena léčba inhibitory tyrosinkinázy (tyrosine kinase inhibitor, TKI). Proto je nutná koordinace všech zúčastněných složek tohoto procesu - odběr materiálu, morfologické vyšetření, molekulárně genetická analýza, zaslání výsledku lékaři. V České republice došlo k dohodě mezi zástupci odborných společností, které hrají roli v procesu diagnostiky a léčby pacientů s NSCLC, a byl vydán Interdisciplinární konsenzus prediktivního molekulárně genetického vyšetřování u NSCLC, jenž je postupně aktualizován. Podle tohoto konsenzu jsou reflexně testováni všichni pacienti s NSCLC (adenokarcinom, spíše adenokarcinom a blíže nespecifikovaný [not otherwise specified, NOS]) ve chvíli, kdy je stanovena morfologická diagnóza. Vzorek by měl být dopraven k histologickému vyšetření do 24 hodin po odběru. K diagnostice je možné použít diagnostický certifikovaný kit pro sekvenování nové generace (next generation sequencing, NGS) ONCO anti-EGFR, což je CE-IVD certifikovaný test, který obsahuje panel genů sestavený podle požadavků klinické praxe pro optimalizaci cílené léčby u onkologických pacientů - NGS kit určený pro diagnostiku nemalobuněčného karcinomu plic (využitelný i u kolorektálního karcinomu). Obsahuje panel vybraných „hot spot“ oblastí, ve kterých se vyskytují mutace důležité pro rozhodnutí, jakou poskytnout cílenou léčbu. Kit je určen na přípravu knihovny vzorků pro sekvenování na přístroji MiSeq a jedná se o metodu amplikonového sekvenování. Součástí kitu je používání vyhodnocovacího softwaru. Pracoviště, které testuje mutace EGFR, musí být schopné provádět molekulárně genetické vyšetření pomocí nejméně dvou nezávislých metod. Laboratoř je povinna se účastnit externího hodnocení kvality. K získání kompletní diagnózy by měla pracoviště dospět maximálně do dvou týdnů od odběru vzorku. Zásadní pro kvalitní výsledek je komplexní součinnost patologa a molekulárního biologa. U vzorků s nízkým poměrem nádorových buněk k buňkám nenádorovým mohou být nádorové buňky selektivně extrahovány metodou laserové mikrodisekce s použitím přístroje PALM Microlaser (Carl Zeiss Microlmaging, Německo). Genomová DNA byla izolována pro mutační analýzu standardní kolonkovou metodou s použitím kitu JetQuick tissue kit (Genomed, Loehne, Německo). Přítomnost EGFR delecí v exonu 19 genu EGFR byla detekována pomocí fragmentační analýzy. Bodové mutace v exonu 21 genu EGFR byly analyzovány použitím vysoce citlivé metody denaturační kapilární elektroforézy. Tato metoda je založena na kapilárně-elektroforetické separaci heteroduplexů za podmínek jejich částečné denaturace. Fragmentační analýza a denaturační kapilární elektroforéza byly prováděny na 96kapilárním sekvenátoru (MegaBACE 1000, GE Biosciences, New Jersey, USA) vybaveném robotickým podavačem vzorků Caddy 1000. Molekulárně genetickým vyšetřením se mohou zpracovávat zaslané vzorky tkáně fixované formaldehydem a zalité v parafínu (formalin fixed paraffin embedded, FFPE). Další možností je vyšetření čerstvé nebo zmražené tkáně, případně vzorku (tkáň nebo cytologický stěr) fixovaného alkoholem. Výhody FFPE představují možnost dlouhodobého uchovávání bez nutnosti hlubokomrazicích boxů a určení podílu nádorových buněk, případně vyznačení oblastí s nejvyšším podílem nádorových buněk patologem. U tohoto materiálu je však třeba mít na paměti, že formaldehyd poškozuje strukturu DNA a se snižujícím se množstvím buněk ve vzorku roste počet artificiálních mutací. V FFPE dochází k fragmentaci DNA, proto je vhodné pro vyšetření mutací EGFR použít metody, které pracují s krátkými úseky DNA. Kvůli nízkému obsahu nádorových buněk nebo velké příměsi nenádorových buněk nejsou v některých případech biopsie pro molekulární analýzu vhodné. U řady takových případů lze zvýšit přesnost molekulární analýzy provedením laserové mikrodisekce, kterou jsou izolovány oblasti vzorku s vyšším obsahem nádorových buněk. V záchytu mutací EGFR nebyl pozorován rozdíl mezi vzorky získanými biopsií nádoru a cytologickými nátěry, které obsahovaly buňky NSCLC. Byla pozorována 97% konkordance ve výsledku vyšetření EGFR mezi současně odebranými cytologickými nátěry a vzorky nádorové tkáně ze stejného místa nádoru. Cytologické vzorky jsou vhodným zdrojem pro molekulární analýzu a k jejich získání lze použít i méně invazivní metody než pro odběr nádorové tkáně. Na rozdíl od vzorků nádorové tkáně je možné cytologické vzorky získat téměř od všech pacientů. Lze je připravit z pleurálního výpotku, sputa, vzorků odebraných bronchoskopií a z materiálu získaného aspirací jemnou jehlou. Stejně jako u vzorků nádorové tkáně jsou i v cytologických vzorcích přítomny nejen buňky nádoru, ale i normální pneumocyty, buňky stromatu a krevní buňky. Existuje riziko, že standardní sekvence EGFR, izolovaná z nenádorových buněk vzorku, může překrýt mutace, které nesou nádorové buňky. Přítomnost nádorových buněk musí být potvrzena před molekulárním vyšetřením, aby se omezilo riziko falešně negativního výsledku. Vzorek je rozdělen na dva alikvoty - v jednom je zhodnocena přítomnost nádorových buněk, druhý je použit k molekulárnímu vyšetření. Pokud vzorek obsahuje méně než 1 % nádorových buněk, je vhodné provést nový odběr. Pro vyšetření cytologických nátěrů se používají vysoce citlivé metody schopné zachytit mutaci v 1 % nádorových buněk.
MOŽNOSTI „TEKUTÉ BIOPSIE"
Molekulární vyšetření periferní krve může poskytnout strategii pro neinvazivní a opakované vyšetřování genotypu nádoru během léčby. U onkologických pacientů je koncentrace DNA cirkulující v plazmě výrazně vyšší než u zdravých jedinců. Volná DNA je uvolňována z buněk podléhajících nekróze nebo apoptóze. Volná DNA pochází z nádorových buněk i ze zdravých buněk, které byly poškozeny růstem nádoru. Značné množství DNA z nádorových buněk NSCLC je uvolněno do krve, tudíž lze cirkulující krev pacientů s NSCLC použít pro mutační analýzu řady genů. Byla prokázána souvislost mezi výsledkem molekulární analýzy EGFR prováděné ze vzorků krevní plazmy a odpovědí na léčbu TKI. Pacienti, v jejichž plazmě byla metodou ME PCR (mutant-enriched polymerase chain reaction) zjištěna aktivující mutace EGFR, měli oproti pacientům s wild-type (wt) EGFR výrazně lepší klinickou odpověď na léčbu gefitinibem a delší dobu bez progrese onemocnění (7,6 vs. 2,9 měsíce). I přímé vyšetření cirkulujících nádorových buněk získaných neinvazivně z krve pacienta může přinést informace o molekulární charakteristice nádoru. Byla také pozorována souvislost mezi poklesem počtu cirkulujících nádorových buněk u pacientů s pokročilým NSCLC v průběhu léčby TKI a klinickou odpovědí. Sangerovo sekvenování je hlavní a standardní metodou používanou pro vyšetření mutací EGFR a má potenciální specifitu 100 %. Přestože komerčně dostupné diagnostické soupravy rozeznávají s vysokou senzitivitou několik typů mutací EGFR, ukázalo se, že celkem 32 % aktivujících mutací EGFR (v exonech 18 až 21 EGFR) zjištěných u NSCLC obousměrným Sangerovým sekvenováním nebylo odhaleno komerčně dostupným PCR kitem (TheraScreen EGFR29 Mutation Kit; DXS Ltd.). Sangerovo sekvenování umožňuje určit všechny mutace v EGFR, jedinou nevýhodou je jeho nízká senzitivita. Je potřeba získat dostatečné množství kvalitní DNA ze vzorku, který obsahuje dostatečné množství nádorových buněk. Warth považuje výsledek Sangerova sekvenování za spolehlivý, pokud patolog odhadne alespoň 40% zastoupení nádorových buněk. Pokud došlo k amplifikaci mutované alely EGFR, může být mutace detekována, i když je podíl nádorových buněk nižší. Detekční limit záleží na typu mutace EGFR. Bodovou mutaci je možné detekovat od minimálního počtu 30 % nádorových buněk ve vzorku. Překryv sekvencí v důsledku posuvu rámce je snáze detekovatelný než bodová mutace. Komplexní mutace, jako jsou delece v exonu 19, je možné zachytit při koncentraci nádorových buněk 10-20 %. Delece v exonu 19 EGFR lze zjistit snadno proveditelnou a časově poměrně nenáročnou metodou fragmentační analýzy. Po provedení běžné PCR (jeden z primerů nese fluorescenční značku) je vyhodnocována délka produktů PCR prostřednictvím kapilární elektroforézy. Pokud je přítomna delece, vzniká nalevo od wt vrcholu na elektroferogramu nový vrchol, který odpovídá kratšímu deletovanému fragmentu. S použitím fragmentační analýzy lze detekovat deleci exonu 19 EGFR ve vzorku s pouhými 5 % nádorových buněk. Metoda alelické diskriminace umožňuje odlišení mutované a wt alely prostřednictvím real-time PCR se sondami TaqMan. Jedna sonda specificky hybridizuj e k wt alele, zatímco druhá se specificky váže k mutované alele vyšetřovaného genu. Každá ze sond nese na jednom konci fluorescenční značku a na druhém zhášeč. Pokud je sonda plně komplementární k sekvenci genu, dojde k hybridizaci sondy k templátové DNA a sonda je následně štěpena 5' ke 3' exonukleázovou aktivitou polymerázy Taq. V takovém případě se uvolní flurofor (odlišný pro mutovanou a pro wt sondu) a je detekována fluorescence. PCR obohacená o mutovanou alelu využívá změnu sekvence způsobenou mutací ke specifickému štěpení wt DNA, čímž se zvyšuje pravděpodobnost amplifikace méně zastoupené mutované DNA ve druhé PCR. Nejprve byla tato metoda použita pro detekci dvou nej častějších aktivujících mutací EGFR. Pro štěpení exonu 19 po první PCR je využíván enzym MseI, který rozpoznává a štěpí sekvenci TATAA, která v důsledku delece není přítomna. Sekvence TTAA se nachází v exonu 19 dvakrát. Proto je používán mismatch primer, který odstraní jedno rozpoznávací místo. Tím umožní, že produkty první PCR budou štěpeny jen v rozpoznávacím místě, které leží v často deletované oblasti exonu 19 EGFR. Pro zviditelnění mutace L858R v exonu 21 je DNA po první PCR štěpena enzymem MscI, jenž rozpoznává a štěpí sekvence s motivem TGGACCA. Tato sekvence je pozměněna v důsledku mutace L858R. V případě exonu 21 se provádí po druhé PCR ještě štěpení mutované alely enzymem Sau96I, který rozpoznává a štěpí sekvenci GaGNCC přítomnou pouze v amplikonu, jenž nese mutaci L858R. Důvodem je, že mutovanou alelu od kompletně nenaštěpené wt alely nelze rozlišit jiným způsobem než podle délky. K vyhodnocení lze použít polyakrylamidovou nebo agarózovou gelovou elektroforézu, kapilární elektroforézu, nebo přímé sekvenování. Metodou ME PCR je možné detekovat jeden mutovaný gen na pozadí 2 000 wt genů. Principem EGFR StripAssay detekční soupravy je selektivní hybridizace produktů PCR k testovacím nitrocelulózovým proužkům, které obsahují alelově specifické (wt a mutované) oligonukleotidové sondy. Ty jsou imobilizované na stripu ve formě paralelních proužků. Pokud sekvence biotinylovaného produktu PCR obsahuje shodu se sondou, naváže se na ni a díky 26 streptavidin-alkalinové fosfatáze a barevnému substrátu je proužek na stripu zviditelněn. Výrobcem deklarovaná citlivost je 1 % mutace na pozadí wt alel. Tato metoda umožňuje určit 16 mutací v exonech 18 až 21 EGFR (exon 18: G719C, G719S, G719A, exon 19: E746_A750del (2249del), E746_A750del (2250del), E746_T751delinsA, E746_S752delinsV, L747_A750delinsP, L747_T751delinsP, L747_T751del, L747_P753delinsS, L747_S752del, L747_E749del, exon 20: T790M, exon 21: L858R, L861Q). Další možností testování je detekční souprava Cobas EGFR Mutation Test, což je multiplexní test, který využívá alelově specifickou PCR v reálném čase a umožňuje detekovat 41 mutací v exonech 18, 19, 20 a 21 genu EGFR. Tímto testem lze určit mutaci, pokud je přítomno alespoň 5 % mutovaných alel. Proces od izolace DNA, přes amplifikaci a detekci k získání výsledků může trvat méně než 8 hodin. Analýza dat a vyhodnocení výsledků jsou plně automatizované, což představuje výhodu oproti Sangerovu sekvenování, kde existuje při vyhodnocení riziko subjektivní chyby. Další výhody cobas testu oproti Sangerovu sekvenování představují větší robustnost a rychlost. Zatímco cobas test vykázal 3 % neplatných vzorků, Sangerovým sekvenováním nebylo možné získat výsledek v 23,8 % případů. Jedním cobas kitem lze za jeden den otestovat 24 vzorků, oproti tomu Sangerovo sekvenování stejného počtu vzorků trvá zhruba pět dní. Při testování FFPE bylo potvrzeno, že Cobas EGFR Mutation Test detekuje mutace s vysokou senzitivitou a mezi výsledky této soupravy a soupravy TheraScreen EGFR29 Mutation Kit, u níž byla rovněž prokázána vysoká senzitivita detekce mutací EGFR, je vysoká shoda. Tato tzv. „tekutá biopsie“ dokáže s vysokou specificitou identifikovat mutace EGFR, a je možné ji proto použít jako alternativní způsob prediktivního testování. Je však třeba mít na paměti zásadní limitace takového přístupu. Volná DNA se do plazmy dostává nejen z nádorových elementů, ale i ze všech dalších rozpadajících se buněk (normální tkáně, zánětlivé elementy apod.). Zatímco specificita a pozitivní predikční hodnota „tekuté biopsie“ je vysoká (zpravidla nad 90 %), její senzitivita a negativní predikční hodnota není zcela uspokojivá a pohybuje se v rozmezí 65-75 %.
EGFR - LÉČEBNÝ CÍL
Struktura receptoru pro EGF s tyrosinkinázovou doménou předurčuje její terapeutické ovlivnění pomocí tyrosinkinázových inhibitorů, což jsou nízkomolekulární organické sloučeniny s vysokou afinitou k biopolymerům, které vazbou na tento receptor exprimovaný na povrchu nádorových buněk blokují signální dráhy do buněčného jádra. Ty ve svém důsledku ovlivňují vlastnosti buňky, které ji činí maligní. V léčbě pokročilého nemalobuněčného karcinomu plic jsou dosud využívány inhibitory tyrosinkinázy EGFR první a druhé generace - erlotinib, gefitinib, afatinib. Dalším léčebným ovlivněním EGFR jsou monoklonální protilátky cílené proti extracelulární doméně tohoto receptoru - cetuximab. Cetuximab je chimérická (myší/lidská) protilátka třídy IgG1, která působí jako kompetitivní inhibitor o vazbu na extracelulární doménu EGFR s přirozenými ligandy, jimiž jsou EGF a TGF-α. Cetuximab má k EGFR vyšší afinitu než růstové faktory, přičemž jeho vazba blokuje dimerizaci receptoru a tím spuštění navazující signální kaskády. Zkoumanou oblastí zůstává skupina látek tvořených konjugáty ligandů (EGF, TGF-α) s toxiny (pseudomonádový exotoxin A). Nadále se budeme zabývat hlavní skupinou schopnou fosforylovat tyrosinkinázovou doménu v intracelulární části EGFR.
INHIBITORY TYROSINKINÁZY EGFR PRVNÍ GENERACE
Gefitinib
Byl jako první v Evropské unii a také v České republice v této indikaci k dispozici, a to na základě úspěšné studie z roku 2009 IPASS (IRESSA Pan-Asia Study), což byla randomizovaná dvojitě zaslepená studie srovnávající gefitinib vs. carboplatinu + paclitaxel jako léčbu první linie v pokročilém NSCLC. Studie IPASS sledovala 1 217 pacientů s potvrzenou histologií adenokarcinomu, kteří byli bývalí kuřáci nebo nikdy nekouřili. Předem naplánované analýzy podskupin ukázaly, že přežití bez progrese (progression free survival, PFS) bylo významně delší při podávání gefitinibu oproti chemoterapii u pacientů s nádory s pozitivní mutací EGFR (poměr rizik [hazard ratio, HR] 0,48; 95% interval spolehlivosti [confidence interval, CI] 0,36-0,64; p < 0,0001) a signifikantně delší pro chemoterapii než gefitinib u pacientů s nádory bez EGFR mutace (HR 2,85; 95% CI 2,05-3,98; p < 0,0001). Tato analýza a výsledek studie v roce 2009 poprvé prokázaly výrazně delší PFS u cílené monoterapie oproti dubletové chemoterapii. V České republice se gefitinib užívá od února 2011 a výsledky jím léčených pacientů jsou srovnatelné s výsledky, kterých bylo dosaženo ve studii IFUM, což byla jednoramenná otevřená multicentrická studie fáze IV, provedená u pacientů bělošské rasy (n = 106) s NSCLC s aktivační mutací EGFR. Ve studii IFUM byl medián času do progrese (median progression free survival, mPFS) 9,7 měsíce a medián celkového přežití (median overall survival, mOS) 19,2 měsíce. Publikovaná data z České republiky představují zpracované výsledky léčby gefitinibem u 187 pacientů. V České republice bylo u nemocných s přítomností běžných aktivačních mutací genu pro EGFR (n = 113) dosaženo PFS 10,2 měsíce a mOS byl 22,7 měsíce. Odpověď na léčbu gefitinibem vykazuje úzkou korelaci s přítomností aktivačních mutací v EGFR (až 70 % vs. 10 % odpovědí pro pacienty bez aktivační mutace). Mutantní kináza EGFR má vyšší afinitu k TKI než nemutovaná. Tolerance gefitinibu je velmi dobrá s nízkou toxicitou; na rozdíl od ostatních podobných přípravků může častěji způsobovat elevaci jaterních enzymů. V současnosti je gefitinib indikován u pacientů s lokálně pokročilým nebo metastazujícím NSCLC pouze tehdy, je-li v nádorové DNA zjištěna aktivační mutace v EGFR.
Erlotinib
Jedná se o další přípravek první generace TKI. Studie fáze III EURTAC (The EURopean TArceva vs. Chemotherapy) hodnotila erlotinib oproti chemoterapii v první linii léčby kavkazských pacientů s pokročilým NSCLC nesoucích aktivační mutaci genu pro EGFR, prokázala signifikantní prodloužení PFS u pacientů s NSCLC a aktivační mutací EGFR, což umožnilo zařazení erlotinibu do první linie léčby pokročilého NSCLC s prokázanou aktivační mutací EGFR. Účinnost a bezpečnost erlotinibu u NSCLC byla stanovena v randomizované dvojitě zaslepené, placebem kontrolované klinické studii (BR.21) u 731 pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic po selhání alespoň jednoho režimu chemoterapie. V této studii byli pacienti randomizováni v poměru 2 : 1 do skupiny, v níž byl perorálně podáván přípravek erlotinib v dávce 150 mg jednou denně, a do skupiny, v níž bylo podáváno placebo. Primárním konečným výstupem studie byla doba přežití signifikantně delší ve skupině nemocných, jimž byl podáván erlotinib. Medián celkové doby přežití ve skupině léčené erlotinibem byl 6,7 měsíce (95% CI 5,5-7,8 měsíce) a bylo dosaženo zlepšení o 42,5 % při srovnání se 4,7 měsíce (95% CI 4,1-6,3 měsíce) ve skupině s podáváním placeba. Dosažený poměr rizik úmrtí ve skupině léčené erlotinibem ve vztahu ke skupině, jíž bylo podáváno placebo, byl 0,73 (95% CI 0,60-0,87; p = 0,001). Procentuální zastoupení pacientů s dobou přežití 12 měsíců bylo ve skupině léčené erlotinibem 31,2 % a ve skupině, která dostávala placebo, 21,5 %. I erlotinib se podává perorálně a je dobře snášen. V České republice je erlotinib u nemocných s přítomností aktivačních mutací po stanovení diagnózy podáván od prosince 2013. Na rozdíl od ostatních inhibitorů tyrosinkinázy byl erlotinib indikován také ve druhé a třetí linii léčby u nemocných s NSCLC, u kterých nebyla prokázána mutace genu pro EGFR. Tato indikace je v naší republice schválena od roku 2005. Podle nových podmínek úhrady je erlotinib možné podávat nadále v první linii pacientům s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic (stadium IIIB nebo IV), starších 18 let, u kterých byly relevantní molekulárně biologickou metodou prokázány aktivační mutace EGFR. Pacienti nemají symptomatické metastázy v centrálním nervovém systému (CNS) a jsou v celkovém stavu (performance status, PS) 0-2. Erlotinib je hrazen u pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic v případě selhání předchozí chemoterapeutické léčby. U pacientů, kteří nemají relevantní molekulárně biologickou metodou prokázány aktivační mutace EGFR (pacienti s EGFR wt NSCLC, pacienti, u kterých nebylo možné nádorovou tkáň otestovat, pacienti se skvamózním NSCLC), je erlotinib hrazen pouze v případech, kdy nelze použít jinou než podpůrnou péči, za kumulativního splnění následujících podmínek: a) nelze podat další linii chemoterapie; b) nelze podat imunoterapii. Zhodnocení dosavadního průběhu léčby a klinického stavu pacienta a důvody nepodání další linie chemoterapie nebo imunoterapie musí být zaznamenány do zdravotní dokumentace pacienta, kdy důvodem nemůže být pouhý nesouhlas pacienta, ale např. kontraindikace, nesplnění indikačních kritérií, celkový zdravotní stav pacienta.
INHIBITORY TYROSINKINÁZY EGFR DRUHÉ GENERACE
Afatinib
Afatinib, anilinochinazolin druhé generace, se ireverzibilně váže na intracelulární doménu tyrosinkinázy a následně inhibuje členy rodiny receptorů ErbB. Konkrétně afatinib inhibuje receptory EGFR (ErbBl), HER2 (ErbB2) a HER4 (ErbB4). Schopnost inhibovat více cílů může být výhoda oproti erlotinibu a gefitinibu, které reverzibilně inhibují pouze EGFR (ErbBl). Nevratné vazebné vlastnosti afatinibu mohou být také výhodou při inhibici mutantních buněčných linií, včetně mutací EGFR L858R/T790M, které jsou často rezistentní na erlotinib a gefitinib. Afatinib se váže kovalentní vazbou na tyrosinkinázovou doménu receptorů 1, 2, 4 a ireverzibilně blokuje všechny homodimery i heterodimery v rámci členů rodiny ErbB; ErbB3 nemá tyrosinkinázovou doménu a je inhibován nepřímo inhibicí ostatních členů rodiny. Afatinib v monoterapii u pacientů s pokročilým adenokarcinomem plic byl hodnocen v šesti klinických studiích programu LUX-Lung, a to v první, druhé a třetí linii léčby. Ve studii LUX-Lung 5 byl afatinib hodnocen v kombinaci s chemoterapií. Afatinib u pacientů bez předchozí léčby TKI ve studii LUX-Lung 3 byl porovnáván s chemoterapií na bázi platiny. Ve studii bylo randomizováno 345 pacientů, z nichž 49 % mělo deleci v exonu 19 (del19) a 40 % mělo bodovou mutaci L858R. Pacienti léčení afatinibem dosáhli signifikantně delšího PFS než při chemoterapii (11,1 vs. 6,9 měsíce; HR 0,58; 95% CI 0,43-0,78; p = 0,001), měli také vyšší četnost léčebných odpovědí (objective response rate, ORR), delší trvání odpovědi na léčbu (duration of response, DoR) a delší dobu, kdy bylo onemocnění kontrolované (duration of disease control, DoDC). Medián OS byl v obou terapeutických ramenech podobný (28,2 měsíce). Signifikantně delšího OS oproti chemoterapii ale dosáhli pacienti s mutací del19 léčení afatinibem - 33,3 vs. 21,1 měsíce (HR 0,54; 95% CI 0,36-0,79; p = 0,0015). Do studie LUX-Lung 6 byli zařazeni výhradně asijští pacienti (n = 364). Více než 90 % nemocných mělo onemocnění ve čtvrtém stadiu. Pacienti byli randomizováni buď k podávání afatinibu, nebo k léčbě kombinací cisplatiny a gemcitabinu. Nejčastější mutaci EGFR byla del19 (51 %) a L858R (38 %). Medián PFS byl 11,0 měsíce u pacientů s afatinibem a 5,6 měsíce u nemocných léčených cisplatinou a gemcitabinem (HR 0,28; 95% CI 0,20-0,39; p < 0,0001). Podávání afatinibu bylo také spojeno s větším podílem odpovědí na léčbu a delším DoR a DoDC. Rozdíl v OS mezi léčebnými skupinami nebyl statisticky významný (23,1 měsíce pro afatinib oproti 23,5 měsíce pro chemoterapii; p = 0,61). I v této studii dosahovali pacienti s del19 léčení afatinibem signifikantně delšího OS (31,4 měsíce) ve srovnání s chemoterapií (18,4 měsíce; HR 0,64; 95% CI 0,44-0,94; p = 0,023). Ve skupině s afatinibem popisovalo více pacientů zlepšení kašle, dušnosti a bolesti. Cílem studie LUX-Lung 7 bylo prospektivně porovnat účinnost a bezpečnost afatinibu a gefitinibu v první linii léčby pacientů s NSCLC a častými mutacemi EGFR (del19 nebo mutace L858R). Primárními sledovanými parametry byly PFS hodnocené nezávislou komisí, doba do selhání léčby (time to treatment failure, TTF) a OS. Při mediánu délky sledování 27,3 měsíce bylo při terapii afatinibem v porovnání s gefitinibem zaznamenáno snížení rizika progrese onemocnění o 27 % (medián PFS, hodnocený nezávislou komisí, 11,0 měsíce vs. 10,9 měsíce; HR 0,73; 95% CI 0,57-0,95; p = 0,017). Rovněž ORR byla vyšší ve skupině léčené afatinibem v porovnání s gefitinibem - 70 % vs. 56 % (OR 1,87; p = 0,0083). Medián DoR byl 10,1 měsíce (afatinib) vs. 8,4 měsíce (gefitinib). Medián TTF byl signifikantně delší ve skupině léčené afatinibem než ve skupině s gefitinibem - 13,7 vs. 11,5 měsíce (HR 0,73; 95% CI 0,58-0,92; p = 0,0073). Podíl pacientů s alespoň 50% zmenšením tumoru byl vyšší ve skupině léčené afatinibem. Mezi terapeutickými skupinami nebyl prokázán významný rozdíl v OS, byl však naznačen trend delšího OS u pacientů léčených afatinibem. Na základě zmíněných výsledků studií lze konstatovat, že v porovnání s chemoterapií afatinib zlepšuje u pacientů dříve neléčených TKI hodnoty PFS, ORR, DoR a DoDC. Účinnost afatinibu je v parametrech 12měsíčního, 18měsíčníno a 24měsíčního PFS v klinických studiích LUX-Lung 3, LUX-Lung 6 a LUX-Lung 7 naprosto konzistentní. Do studie LUX-Lung 1 mohli vstoupit pacienti s adenokarcinomem, kteří byli dříve léčeni chemoterapií, erlotinibem nebo gefitinibem. Ve studii byli nemocní randomizováni do ramene s afatinibem a nejlepší podpůrnou léčbou, nebo do ramene s placebem a nejlepší podpůrnou léčbou; medián OS se mezi rameny významně nelišil (10,8 měsíce afatinib vs. 12,0 měsíce placebo). Naopak PFS bylo významně delší při léčbě afatinibem (3,3 měsíce) než bez něj (1,1 měsíce). Medián DoR s afatinibem činil 24 týdnů. Klinicky významné zlepšení kašle, dušnosti a bolesti zaznamenalo více pacientů ve skupině s afatinibem. Do studie LUX-Lung 4 byli zařazeni pacienti, u kterých při léčbě erlotinibem, gefitinibem nebo oběma došlo k progresi pokročilého NSCLC. Celkem 62 pacientů bylo ve třetí nebo čtvrté linii léčeno afatinibem v monoterapii až do progrese nebo neakceptovatelné toxicity. Medián DoR byl 24,4 týdne, medián PFS 4,4 měsíce a medián OS 19,0 měsíce. Vliv mutačního stavu EGFR (del19 vs. L858R vs. ostatní mutace) na klinické výstupy byl testován ve studii LUX-Lung 2, kde léčebná odpověď byla dokumentována ve vyšší míře (66 %) u pacientů s delecí v exonu 19 a mutací L858R než u pacientů s méně běžnými mutacemi EGFR (39 %). Časté mutace (del19 a L858R) byly také spojeny s delším PFS a OS. V analýze studie LUX-Lung 3, do které byli zařazeni pacienti s běžnými mutacemi EGFR (del19 a L858R), bylo u pacientů léčených afatinibem zaznamenáno významně delší PFS (13,6 měsíce) než u pacientů léčených chemoterapií na bázi platiny (6,9 měsíce) - HR 0,47; 95% CI 0,34-0,65; p = 0,001. Významně vyšší hodnoty PFS byly zachyceny i u pacientů s mutací EGFR léčených afatinibem v klinické studii LUX-Lung 6 (11,0 měsíce vs. 5,6 měsíce na chemoterapii; p < 0,0001). V obou studiích, LUX-Lung 3 a LUX-Lung 6, vedla léčba afatinibem u pacientů s pokročilým plicním adenokarcinomem a potvrzenou mutací EGFR (delece v exonu 19) k signifikantně delšímu OS v porovnání s chemoterapií (LUX-Lung 3: 33,3 měsíce vs. 21,1 měsíce; LUX-Lung 6: 31,4 měsíce vs. 18,4 měsíce). Ve studii LUX-Lung 4 byla u pacientů bez mutace EGFR zaznamenána vyšší ORR než u pacientů s mutací EGFR (27 % vs. 4,5 %). V post hoc analýze kombinovaných dat ze studií LUX-Lung 2, LUX-Lung 3 a LUX-Lung 6, do které byla zařazena data 75 pacientů s málo běžnými mutacemi EGFR, dosáhli při léčbě afatinibem nejlepších výsledků pacienti s bodovými mutacemi a duplikacemi (nebo obojím) v exonech 18-21 (odpověď u 71,1 % pacientů; PFS 10,7 měsíce; OS 19,4 měsíce), odpověď pacientů s de novo mutací T790M v exonu 20 nebo inzercemi v exonu 20 byla omezená. Mutace EGFR jsou u pacientů se skvamózním nemalobuněčným karcinomem plic (squamous NSCLC, sqNSCLC) relativně vzácné - tento typ nádoru je však často spojen s vysokou expresí EGFR a/nebo změnami v počtu kopií EGFR. Proto byly tyrosinkinazové inhibitory EGFR testovány i u pacientů se sqNSCLC. Cílem studie LUX-Lung 8 bylo porovnat účinnost a bezpečnost afatinibu a erlotinibu ve druhé linii léčby pacientů s pokročilým skvamózním karcinomem plic. Již v době primární analýzy PFS (říjen 2013), kdy medián délky sledování činil 6,7 měsíce, bylo zjištěno statisticky významné prodloužení PFS ve skupině s afatinibem v porovnání s erlotinibem (2,4 měsíce vs. 1,9 měsíce; HR 0,82; 95% CI 0,68-1,00; p = 0,0427). V době primární analýzy OS (březen 2015) pak byl medián PFS 2,6 měsíce pro afatinib a 1,9 měsíce pro erlotinib (HR 0,81; 95% CI 0,69-0,96; p = 0,0103). Při délce sledování 18,4 měsíce afatinib v porovnání s erlotinibem rovněž statisticky významně snižoval riziko úmrtí (medián OS 7,9 vs. 6,8 měsíce; HR 0,81; 95% CI 0,69-0,95; p = 0,0077). Pacienti léčení afatinibem měli také lepší hodnoty ORR, DoR a celkově lepší kontrolu nad onemocněním. Signifikantně více pacientů léčených afatinibem než erlotinibem zaznamenalo zmírnění kašle a prodloužení doby do zhoršení dušnosti. Studie LUX-Lung 5 srovnávala účinnost kombinace afatinibu s paclitaxelem oproti chemoterapii podle výběru lékaře u skupiny pacientů s pokročilým NSCLC, u kterých selhala předchozí chemoterapie na bázi platiny nebo léčba erlotinibem, gefitinibem či afatinibem. Delšího PFS dosáhli pacienti v rameni s afatinibem - 5,6 vs. 2,8 měsíce (HR 0,60; 95% CI 0,43-0,85; p = 0,0065). Pacienti s afatinibem v kombinaci s paclitaxelem měli také ve vyšší míře klinický prospěch z léčby a vyšší ORR v porovnání se samotnou chemoterapií. Medián OS se mezi terapeutickými rameny významně nelišil. Do všech klinických studií programu LUX-Lung mohli být zařazeni pacienti s asymptomatickými stabilními mozkovými metastázami. Ve studii LUX-Lung 2 měli pacienti s mozkovými metastázami podobnou odpověď na léčbu jako pacienti bez mozkových metastáz (ORR 65 %, respektive 60 %). Parametry PFS a ORR byly hodnoceny u pacientů s mozkovými metastázami ve studiích LUX-Lung 3 a LUX-Lung 6. Většina těchto pacientů také nesla některou z běžných mutací EGFR (n = 81), menší část pak i méně časté mutace EGFR (n = 10). Kombinovaná analýza dat z obou studií ukázala, že léčba afatinibem u pacientů významně zlepšila medián PFS v porovnání s chemoterapií (8,2 měsíce vs. 5,4 měsíce; HR 0,50; 95% CI 0,27-0,95; p = 0,0297). Medián doby do progrese v CNS byl delší při léčbě afatinibem než při chemoterapii, a to v obou studiích (LUX-Lung 3: 15,2 měsíce vs. 5,7 měsíce; LUX-Lung 6: 15,2 měsíce vs. 7,3 měsíce). Celkové přežití nebylo ovlivněno přítomností či absencí mozkových metastáz, zásadní vliv neměl ani typ mutace EGFR. K nejčastějším nežádoucím účinkům léčby afatinibem patřily průjem, kožní vyrážka, akné a stomatitida. Méně často byly zaznamenány mukozitida a infekce nehtů nebo plic. Nejčastějšími nežádoucími účinky, pro které byla přerušena nebo ukončena léčba afatinibem, byly průjem a kožní reakce. V porovnání s chemoterapií byla incidence nežádoucích účinků stupně 3 při léčbě afatinibem buď srovnatelná (LUX-Lung 3), nebo nižší (LUX-Lung 6). Incidence nežádoucích účinků stupně 1 nebo 2 byla při léčbě afatinibem vyšší než při chemoterapii (LUX-Lung 6). Závažné nežádoucí účinky byly častější u afatinibu oproti gefitinibu (11 % vs. 4 %), přičemž ale míra ukončení léčby pro nežádoucí účinky byla srovnatelná (6 %). Léčba afatinibem byla spojena se srovnatelnou incidencí a závažností nežádoucích účinků jako léčba erlotinibem.
Dacomitinib
Dacomitinib je další inhibitor tyrosinkinázy EGFR druhé generace. V mezinárodní multicentrické randomizované otevřené studii fáze III (ARCHER 1050) byla porovnávána účinnost a bezpečnost dacomitinibu s reverzibilním tyrosinkinázovým inhibitorem EGFR gefitinibem v léčbě první linie u pacientů s pokročilým nemalobuněčným karcinomem plic a s pozitivitou mutací genu pro EGFR. Do studie byli zařazeni dospělí (ve věku nad 18 let) s nově diagnostikovaným pokročilým NSCLC a jednou prokázanou aktivační mutací genu pro EGFR. Nemocní byli randomizováni k perorálnímu podávání dacomitinibu 45 mg/den (v 28denních cyklech), nebo perorálnímu podávání gefitinibu 250 mg/den (v 28denních cyklech). Léčba byla podávána do progrese, pokud nebyla ukončena z jiných důvodů. Primárním cílem bylo PFS, které bylo hodnoceno nezávislou komisí. Bezpečnost byla hodnocena u všech pacientů, kteří dostali alespoň jednu dávku studiové léčby. Do studie bylo zařazeno 452 nemocných (do ramene s dacomitinibem 227 a do ramene gefitinibem 225). Medián PFS byl 14,7 měsíce (95% CI 11,1-16,6) ve skupině s dacomitinibem a 9,2 měsíce (95% CI 9,1 -11) ve skupině s gefitinibem (HR 0,59; 95% CI 0,47-0,74; p < 0,0001). Vyšší účinnost dacomitinibu byla ale doprovázena vyšším výskytem nežádoucích účinků. U 66 % nemocných musela být dávka dacomitinibu redukována. Dacomitinib je ve srovnání s inhibitory EGFR první generace spojen se zvýšenou toxicitou (průjmy, vyrážky, stomatitidy a paronychie). Celková kvalita života ve studiích fáze III byla zachována, nicméně v našich podmínkách není dacomitinib registrován a používán.
VZNIK REZISTENCE VŮČI TKI
V klinické praxi se léčba tyrosinkinázovými inhibitory EGFR vyznačuje rychlým nástupem účinku a vysokou četností léčebných odpovědi. Po tomto léčebně úspěšném období však u většiny (70 %) nemocných dochází v průměru po 10-11 měsících terapie k nástupu rezistence na léčbu a k progresi nádoru. Možných mechanismů sekundární rezistence je celá řada - amplifikace receptoru pro růstový faktor hepatocytů (MET), amplifikace HER2 či transformace na malobuněčný karcinom. Nejčastější příčinou (až v 60 %) získané rezistence k tyrosinkinázovým inhibitorům EGFR je mutace T790M. Tato mutace se nachází na exonu 20 genu pro EGFR a vede k záměně threoninu za methionin na pozici 790 kinázové domény receptoru. Threonin je malá polární aminokyselina, zatímco methionin představuje velkou nepolární molekulu. Tato změna vede ke zvýšení afinity receptoru pro adenosintrifosfát (ATP), a vzniká tak překážka bránící vazbě EGFR-TKI. Mutace navíc zvyšuje vazebnou afinitu EGFR k ATP a výsledkem je opět snížení účinku TKI. Mutaci T790M u nádorů se získanou rezistencí vůči tyrosinkinázovým inhibitorům EGFR (EGFR TKI) zjistíme zhruba u dvou třetin pacientů s pokročilým NSCLC s mutací v genu pro EGFR (EGFRm) (v rozpětí 51-68 %). K dalším cestám vedoucím k rozvoji získané rezistence vůči EGFR TKI patří vytvoření obchvatu v buněčné signalizaci (často spojeného se známými onkogeny, mimo jiné například MET, HER2, BRAF, AXL). K rozvoji získané rezistence mohou přispívat též procesy typu malobuněčné transformace nebo epiteliálně-mezenchymální přeměny. Další mechanismus ztráty odpovědi na léčbu EGFR TKI byl popsán v roce 2007, kdy byla u rezistentních pacientů s NSCLC detekována amplifikace v protoonkogenu MET. Protoonkogen MET kóduje trosinkinázový receptor pro hepatocytární růstový faktor (hepatocyte growth factor receptor, HGFR), jehož zvýšená signalizace podporuje u nádorových buněk přežívání, invazivitu a angiogenezi. Amplifikace MET aktivuje HER3 a PI3K/AKT signální dráhu nezávisle na stimulaci EGFR, a proto může být příčinou vzniku rezistence na TKI. Je možná i současná přítomnost mutace T790M a amplifikace MET.
INHIBITORY TYROSINKINÁZY EGFR TŘETÍ GENERACE
Osimertinib
Byl vyvinut s cílem překonání získané rezistence vůči EGFR TKI. Před indikací léčby lokálně pokročilého nebo metastazujícího NSCLC osimertinibem je nutné stanovit přítomnost mutace T790M genu pro EGFR. Validovaný test má být proveden s použitím DNA získané ze vzorku nádorové tkáně nebo cirkulující nádorové DNA (circulating tumor DNA, ctDNA) získané ze vzorku plazmy. Osimertinib je perorální ireverzibilní inhibitor tyrosinkinázy EGFR s aktivačními mutacemi (EGFRm+) a s rezistentní mutací T790M, je indikován k léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic s prokázanou mutací T790M EGFR. Osimertinib jako zástupce třetí generace TKI však vykazuje nižší inhibiční aktivitu vůči nemutované formě EGFR a významně vyšší účinnost u nádorů se současnou přítomností mutace T790M tím, že cílí a ireverzibilně se váže na EGFR mutaci, která spouští rozvoj nádoru, a zároveň cílí proti mutaci T790M, která je zodpovědná za rezistenci u stávající léčby EGFR TKI. Osimertinib byl schválen Evropskou lékovou agenturou (European Medicines Agency, EMA) dne 2. 2. 2016 v dávce 80 mg v jedné tabletě užívané jedenkrát denně pro léčbu dospělých pacientů s lokálně pokročilým či metastazujícím nemalobuněčným karcinomem plic s pozitivní mutací EGFR T790M, která je rezistentní vůči EGFR TKI. Dne 30. 3. 2017 udělil Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) osimertinibu plné schválení, následně 25. 4. 2017 bylo uděleno úplné schválení rovněž Evropskou komisí. Bezpečnost a účinnost osimertinibu byla zkoumána v klinickém programu AURA. Ten se skládá ze tří studií hodnotících bezpečnost a účinnost u pacientů s pokročilým nebo metastazujícím NSCLC s přítomností aktivačních mutací genu EGFR, kteří progredovali při léčbě inhibitory tyrosinkinázy a u kterých byla prokázána rezistentní mutace T790M. Studie AURA byla otevřená jednoramenná dávkově eskalační studie I. fáze se zvyšující se dávkou osimertinibu, sledující jeho bezpečnost a účinnost, kde četnost léčebných odpovědí dosahovala 62 %, PFS činila 11,0 měsíce. Další navazující studií byla AURA extenze představující jednoramennou otevřenou klinickou studii fáze II s prodlouženou kohortou (n = 201), která hodnotila účinnost osimertinibu v dávce 80 mg u nemocných s lokálně pokročilým nebo metastazujícím NSCLC s prokázanou mutací T790M. Četnost léčebných odpovědí byla 61 %. Studie AURA2 byla otevřená jednoramenná studie II. fáze, v níž byla hodnocena účinnost osimertinibu 80 mg denně u nemocných s lokálně pokročilým nebo metastazujícím NSCLC s progresí po předchozí léčbě EGFR TKI, kteří měli prokázanou mutaci T790M. Primárním sledovaným ukazatelem byla četnost léčebných odpovědí - 70,9 %, medián doby do progrese činil 8,6 měsíce. Do studií II. fáze bylo zařazeno celkem 411 pacientů. Finální analýza obou těchto studií ukázala souhrnnou ORR 66 % (61-71) a medián PFS 9,7 měsíce. Studie fáze III AURA3 byla konfirmační randomizovaná otevřená studie srovnávající osimertinib s chemoterapií založenou na platině u pacientů s pokročilým nebo metastazujícím NSCLC s prokázanou mutací T790M, u kterých došlo k progresi při léčbě TKI první linie. Pacienti (n = 419) byli randomizováni v poměru 2 : 1 k léčbě osimertinibem (n = 279, dávka 80 mg p.o. 1x denně) nebo k léčbě chemoterapií na bázi platiny + pemetrexedu (n = 140). Pacienti bez progrese po čtyřech cyklech chemoterapie mohli pokračovat v udržovací léčbě pemetrexedem. Primárně hodnocený medián PFS posuzovaný zkoušejícími byl statisticky signifikantně vyšší u skupiny pacientů léčených osimertinibem oproti chemoterapii – 10,1 vs. 4,4 měsíce (HR 0,30; 95% CI 0,23-0,41; p < 0,001). Analýza provedená zaslepeným nezávislým centrálním hodnocením potvrdila medián PFS 11,0 vs. 4,2 měsíce ve prospěch osimertinibu (HR 0,28; 95% CI 0,20-0,38; p < 0,001). Míra objektivní odpovědi byla signifikantně vyšší u pacientů léčených osimertinibem oproti pemetrexedu s platinou - 71 vs. 31 % (ORR 5,39; 95% CI 3,47-8,48; p < 0,001). Délka trvání odpovědi (DoR) na základě posouzení zkoušejícího prokázala 9,7 měsíce (95% CI 8,3-11,6) ve skupině osimertinibu a 4,1 měsíce (95% CI 3,0-5,6) u pacientů léčených platinovým derivátem a pemetrexedem. Vzhledem k délce přežívání části pacientů nebyly údaje o celkovém přežití při počáteční analýze OS úplné. Do studie AURA3 mohli být zařazeni také pacienti s asymptomatickými metastázami CNS nevyžadujícími léčbu kortikosteroidy po dobu alespoň čtyř týdnů před zahájením studijní léčby (n = 144). Rovněž u této skupiny byl medián PFS signifikantně vyšší ve skupině pacientů léčených osimertinibem - 8,5 vs. 4,2 měsíce (HR 0,32; 95% CI 0,21-0,48; p < 0,001). Přežití bez progrese v CNS bylo potvrzeno zaslepeným nezávislým centrálním hodnocením (pacienti s prokázanými metastázami podle vstupního skenu mozku, n = 116/419) a činilo 11,7 vs. 5,6 měsíce (HR 0,32; 95% CI 0,15-0,69; p < 0,004) ve prospěch osimertinibu oproti chemoterapii. Osimertinib má nízké procento nežádoucích účinků vyššího stupně. Většina nežádoucích účinků (690 pacientů s NSCLC s mutací T790M EGFR léčených v obou jednoramenných studiích fáze II a ve studii fáze III) byla intenzity stupně 1 nebo 2. Nejčastěji hlášenými nežádoucími účinky byly průjem (44 %) a vyrážka (41 %). Dalšími velmi častými nežádoucími účinky byla suchá kůže (29 %), paronychie (27 %), stomatitida (15 %) a pruritus (15 %). Z laboratorních hodnot potom bylo zjištěno snížení počtu leukocytů (66 %), trombocytů (54 %) a neutrofilů (32 %). Nejčastěji se závažnost těchto nežádoucích účinků pohybovala na stupni 1 a 2, výskyt příhod stupně 3 a vyšších byl nízký. Ke snížení dávky v důsledku nežádoucích účinků u pacientů léčených osimertinibem se přistoupilo u 2,3 % nemocných. K vysazení léčby v důsledku nežádoucích účinků nebo abnormálních laboratorních hodnot bylo nutné přistoupit u 6,5 % pacientů. Vzhledem k profilu aktivity osimertinibu (běžné senzitivující mutace + rezistentní mutace T790M) bylo dalším logickým krokem ve vývoji molekuly ověření jejího účinku v první linii léčby u nemocných nemalobuněčným karcinomem s mutacemi genu pro EGFR.
Účinnost osimertinibu v první linii léčby u pacientů s mutovaným EGFR byla zkoušena v rámci mezinárodní randomizované a dvojitě zaslepené studie fáze III FLAURA. V listopadu 2017 byly prezentovány první výsledky této studie. Tato studie porovnávala TKI třetí generace, osimertinibu, oproti TKI první generace - gefitinibu nebo erlotinibu, a to u dosud neléčených pacientů s lokálně pokročilým nebo metastazujícím NSCLC s prokázanou aktivační mutací (delecí na exonu 19 nebo bodovou mutací L858 na exonu 21). Pacienti byli randomizováni 1 : 1 k léčbě osimertinibem 80 mg denně (279 nemocných) a k léčbě gefitinibem 50 mg denně nebo erlotinibem 150 mg denně (277 nemocných). Do studie byli zařazeni i pacienti s mozkovými metastázami (22 %). Primárním cílovým parametrem účinnosti bylo PFS podle posouzení zkoušejícího. Medián PFS byl statisticky signifikantně vyšší u skupiny pacientů léčených osimertinibem oproti nemocným, kteří byli léčeni gefitinibem nebo erlotinibem - 18,9 měsíce vs. 10,21 měsíce (HR 0,46; 95% CI 0,37-0,57; p < 0,001). Míra objektivní odpovědi byla podobná u obou skupin: 80 % ve skupině s osimertinibem a 76 % ve skupině s gefitinibem nebo erlotinibem (HR 1,27; 95% CI 0,85-1,9; p = 0,24). Délka trvání odpovědi na základě posouzení zkoušejícího byla 17,2 měsíce (95% CI 13,8-22,0) ve skupině s osimertinibem a 8,5 měsíce (95% CI 7,3-9,8) u pacientů léčených gefitinibem nebo erlotinibem. Výchozí demografické charakteristiky a charakteristiky onemocnění celkové populace ve studii byly následující: medián věku v obou skupinách 64 let, ženy 36 % a 38 %, běloši 36 % v obou skupinách, Asiaté 62 % v obou skupinách, nekuřáci 65 % a 63 %; stav výkonnosti podle WHO 0 nebo 1 byl v obou skupinách 100 %. Mimohrudní viscerální metastázy mělo 34 % a 37 % nemocných, metastázy do mozku 19 % a 23 % nemocných. Delece na exonu 19 byla přítomna u 57 % a 56 % nemocných a bodová mutace na exonu 21 u 35 % a 32 % nemocných. Podíl pacientů s výskytem nežádoucích účinků stupně 3 a vyššího byl menší ve skupině léčené osimertinibem (23 %) než ve skupině pacientů léčených gefitinibem nebo erlotinibem (34 % vs. 45 %). Z této studie vyplývá, že osimertinib byl u dosud neléčených nemocných s pokročilým NSCLC a s přítomností aktivační mutace genu pro EGFR účinnější než gefitinib nebo erlotinib. I ve studii FLAURA bylo dosaženo benefitu z hlediska PFS jak u skupiny pacientů s mozkovými metastázami při vstupu do studie (známé nebo léčené metastázy v CNS, n = 116, PFS 15,2 vs. 9,6 měsíce; HR 0,47; 95% CI 0,30-0,74; p < 0,001), tak u pacientů bez nich. Z celkového počtu 556 pacientů bylo identifikováno 128 pacientů s měřitelnými či neměřitelnými metastázami v CNS při vstupu do studie. Osimertinib prokázal prodloužení PFS oproti rameni, ve kterém byli nemocní léčeni gefitinibem nebo erlotinibem (HR 0,48; 95% CI 0,26-0,86; p = 0,014). Míra objektivních odpovědí u nemocných s mozkovými metastázami činila 66 % (95% CI 52-77) oproti 43 % (95% CI 31-56), míra kontroly nemoci (disease control rate, DCR) dosáhla 90 % (95% CI 80-96) v rameni s osimertinibem a 84 % (95% CI 73-92) v rameni, ve kterém byli nemocní léčeni gefitinibem nebo erlotinibem. V podskupině s minimálně jednou měřitelnou metastatickou lézí v CNS (n = 41) bylo dosaženo ORR v 91 % (95% CI 71-99) v rameni s osimertinibem a 68 % (95% CI 43-87) v rameni s léčbou gefitinibem nebo erlotinibem. Míra kontroly nemoci činila 95 % (95% CI 77-100) vs. 89 % (95% CI 67-99). Uvedená data potvrzují vysokou účinnost osimertinibu u nemocných s mozkovými metastázami v době stanovení diagnózy. V září 2019 byly prezentovány definitivní výsledky OS ve studii FLAURA: medián OS v rameni s osimertinibem činil 38,6 měsíce ve srovnání s 31,6 měsíce s erlotinibem nebo gefitinibem, což představuje 20% snížení rizika úmrtí (HR 0,799; p = 0,0462) (graf 1). Osimertinib je tak jedinou léčbou s mediánem celkového přežití přes tři roky pro první linii lé čby pro p okro čilý či generalizovaný NSCLC. Po třech letech zůstalo na léčbě první linie 28 % pacientů s osimertinibem a pouze 9 % pacientů v rameni EGFR komparátoru, a to i přes zkřížení mezi rameny. Kromě významně vyššího mediánu PFS, jak již bylo výše uvedeno, dokázal osimertinib v první linii léčby významně snížit riziko progrese v CNS - o 52 % ve srovnání s erlotinibem/gefitinibem (HR 0,48; p = 0,014).
Molekula osimertinibu se stala předmětem i adjuvantní studie. Na jaře 2020 byly na ASCO k dispozici první publikovatelné výsledky studie ADAURA fáze III, ve které pacientům po kompletní resekci tumoru stadia IB-IIIA s přítomnou mutací EGFR (del19 nebo L858R) byla podávána adjuvantní terapie osimertinibem po dobu maximálně tří let ve srovnání s placebem, do studie bylo zařazeno 682 nemocných po resekci a byli randomizováni 1 : 1 do ramene s osimertinibem vs. placebo. Medián přežití bez nemoci (disease free survival, DFS) pro placebovou skupinu pro všechna stadia IB-IIIA byl již dosažen - 28,1 měsíce, u pacientů s podáváním osimertinibu nebyl tento medián ještě dosažen (HR 0,21; 95% CI 0,16-0,28; p < 0,0001). Pro jednotlivá pooperační stadia bylo zhodnoceno následující: u stadia IB s podáváním osimertinibu dva roky bez onemocnění přežívá 87 % (77-93 %) nemocných oproti 73 % (62-81 %) na placebu (HR 0,5; 95% CI 0,25-0,96). U stadia II pacientů s osimertinibem dva roky bez známek recidivy onemocnění je 91 % oproti 56 % nemocných s placebem (HR 0,17; 95% CI 0,08-0,31), pro stadium IIIA je dva roky bez recidivy na osimertinibu 88 % nemocných (95% CI 79-94 %), u kontrolní skupiny nemocných je to jen 32 % pacientů (95% CI 23-42 %), HR 0,12 (95% CI 0,07-0,2). Ze zveřejněných dat je jasně patrné, že všichni operovaní s EGFR mutovaným plicním karcinomem zejména u stadií II a IIIA jednoznačně profitují z následné terapie osimertinibem a dosahují výrazně lepšího období bez známek recidivy nádorového onemocnění.
DALŠÍ ZKOUMANÉ MOLEKULY S TKI AKTIVITOU
Rociletinib je další selektivní inhibitor tyrosinkinázy s minimální aktivitou vůči receptoru wt NSCLC. Ve studii fáze I/II (TIGER-X) byl rociletinib testován u nemocných se získanou rezistencí na první či druhou generaci tyrosinkinázových inhibitorů EGFR. V expanzní kohortě studie ve fázi II pak byli zařazováni výhradně nemocní s pozitivitou T790M. Testovaly se dávky 500, 625 a 750 mg rociletinibu dvakrát denně, maximální tolerovaná dávka nebyla nalezena. Nej častějším nežádoucím účinkem stupně 3 byla hyperglykemie, která se vyskytla u 22 % pacientů. Léčebné odpovědi bylo dosaženo u 59 % nemocných s pozitivitou T790M a u 29 % pacientů bez mutace T790M. V další studii fáze II (TIGER-2) byli léčeni nemocní se získanou pozitivitou T790M po předchozí terapii inhibitory tyrosinkinázy. Četnost léčebných odpovědí byla 30,2 % při použití dávky 625 mg a 23 % při dávce 500 mg. Kombinovaná nezávislá analýza výše provedených studií prokázala ORR 45 % u T790M pozitivní populace a 17 % u T790M negativní populace. Na základě těchto výsledků byl zastaven nábor do studie a byla stažena žádost o registraci rociletinibu v Evropské unii.
Olmutinib je selektivní inhibitor EGFR s aktivitou proti T790M. Ve studii fáze I provedené u korejských nemocných vykázal v dávkách 75-1 200 mg denně ORR 58,8 %. Hlavní toxicita byla gastrointestinální (průjmy) a elevace hodnot aspartátaminotransferázy (AST), alaninaminotransferázy (ALT), amylázy a lipázy. Pro další vývoj byla určena dávka 800 mg za den, kterou bylo v následné studii fáze II u nemocných s pozitivitou T790M dosaženo ORR 61 % a medián PFS 6,9 měsíce. Na základě těchto dat získal olmutinib v roce 2016 registraci v Jižní Koreji a byl zahájen rozsáhlý testovací program olmutinibu pod názvem ELUXA. Pro neočekávaný nárůst výskytu toxicity stupně 3 a 4 (epidermolýza) byl tento program nakonec zastaven.
Naquotinib je další ireverzibilní tyrosinkinázový inhibitor EGFR s aktivitou proti T790M a omezenou aktivitou proti EGFR wt NSCLC. Kromě rezistentní mutace T790M mohou být příčinou neefektivnosti léčby TKI aktivace alternativních signálních drah, jako jsou MET, HER2 nebo AXL. Nadměrná exprese AXL a rezistence zprostředkovaná AXL byla detekována u mnoha lidských zhoubných nádorů, včetně nádorů prsu, pankreatu, prostaty a NSCLC. Zvýšená exprese AXL v nádorech je často výsledkem farmakologického selektivního tlaku po více chemoterapiích a cílených terapiích. Inhibice aktivovaného EGFR může spustit přechod tyrosinkinázy na transaktivaci AXL a jeho kaskádové signální dráhy, aby se udržel růst nádoru, za předpokladu, že sdílejí stejné signální dráhy, jako jsou MAPK/ERK a PI3K/AKT cesty. AXL může zprostředkovat získanou rezistenci na TKI v epiteliálním přechodu na mezenchymální přechodné nastavení v EGFRm NSCLC. Tato zjištění naznačují, že AXL je potenciálním terapeutickým cílem u pacientů s NSCLC se získanou rezistencí na EGFR TKI. Naquotinib se kovalentně váže na Cys-797 zbytek EGFR L858R/T790M prostřednictvím své akrylamidové skupiny. V preklinických modelech naquotinib prokázal aktivitu i proti buněčným liniím rezistentním na osimertinib a rociletinib. V eskalační studii fáze I byly testovány dávky 25-600 mg/den; léčebných odpovědí bylo dosaženo až u dávek vyšších než 100 mg/den. Testovala se účinnost u T790M pozitivních i negativních nemocných, ORR u T790M pozitivních pacientů byla 80 %. Mezi nežádoucími účinky dominovaly průjem, nauzea, zvracení a trombocytopenie. Ve studii s T790M pozitivními nemocnými byla použita dávka 300 mg a nemocní již byli po léčbě inhibitory tyrosinkinázy. Léčebná odpověď byla 30 % a medián PFS šest měsíců. Probíhá studie fáze III (SOLAR), která porovnává naquotinib proti erlotinibu/gefitinibu v první linii léčby u nemocných s pokročilým CFR mutovaným NSCLC.
Nazartinib je rovněž ireverzibilní kovalentní tyrosinkinázový inhibitor EGFR se specifickou aktivitou proti del19, L858R i T790M, který má až 60násobnou selektivitu oproti wt EGFR in vitro. Ve studii fáze I byly testovány dávky 75-350 mg denně. Četnost léčebných odpovědí byla 46,9 %, míra kontroly nemoci 87,1 % a medián PFS 9,7 měsíce. Nejčastějšími nežádoucími účinky byly průjem, vyrážka a svědění.
Avitinib je další molekula s aktivitou proti T790M a minimální aktivitou proti wt NSCLC. Dosud probíhají studie s tímto přípravkem.
ZÁVĚR
Poznání existence somatických mutací v genu pro EGFR a jejich vlivu na senzitivitu k léčbě inhibitory tyrosinkinázy patří mezi průlomové okamžiky v léčbě nemalobuněčného karcinomu plic. Mutace se vyskytují v oblasti tyrosinkinázové domény mezi exonem 18 a 21 genu pro EGFR, převážně se jedná o bodové záměny a delece, eventuálně inzerce. Mezi tzv. aktivační mutace patří také bodová mutace G719X v exonu 18, bodové mutace L858R a L861Q v exonu 21 a delece v exonu 19. Mezi tzv. rezistentní mutace patří inzerce v exonu 20, bodové mutace T7901v1 a S768I v exonu 20 a bodová mutace D761Y v exonu 19. Velkým pokrokem byl počátkem tohoto tisíciletí vývoj tyrosinkinázových inhibitorů první a druhé generace - gefitinibu, erlotinibu a afatinibu, které jsou účinné u nemocných s NSCLC a přítomností aktivačních mutací genu pro EGFR. Dalším průlomem je příchod osimertinibu, jenž je účinný u nemocných s přítomností rezistentní mutace genu pro EGFR T790M, ale i pro původní mutovaný typ EGFR a prokázal podstatně lepší účinek i v první linii léčby ve srovnání se starší generací TKI. V USA a Japonsku již od roku 2018 a v některých dalších zemích (od roku 2019 v Belgii, Rakousku, Švédsku, Dánsku, Izraeli, Španělsku, Itálii a Německu a od roku 2020 v Nizozemí, Norsku, Finsku a Rusku) je osimertinib možné používat do první linie při zjištění jakékoliv mutace EGFR u pokročilého NSCLC (bez ohledu na přítomnost rezistentní mutace), v našich úhradových podmínkách je osimertinib indikován jen v případě pokročilého nebo metastazujícího NSCLC s průkazem rezistentní mutace T790M po selhání předchozí terapie TKI první nebo druhé generace. V adjuvantním podání po resekci EGFR mutovaného bronchogenního karcinomu prokázal osimertinib jednoznačný přínos ve výrazném prodloužení období do recidivy onemocnění. Ve studiích s pokročilým plicním karcinomem právě osimertinib nejvíce snížil riziko metastatického postižení či jeho progrese při již přítomném postižení CNS.
LITERATURA
- Balak MN, Gong Y, Riely GJ, et al. Novel D716Y and common secondary T790M mutations in epidermal growth factor receptor-mutant lung adenocarcinomas with acquired resistance to kinase inhibitors. Clin Cancer Res 2006;12:6494-6501.
- Ballard P, Yates JW, Yang Z, et al. Preclinical comparison of osimertinib with other EGFR-TKIs in EGFR-mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res 2016;22:5130-5140.
- Campo M, Gerber D, Gainor JF, et al. Brief report: Acquired resistance to first-line afatinib and the challenges of pre-arranged progression biopsies. J Thorac Oncol 2016;11:2022-2026.
- Cortot AB, Janne PA. Molecular mechanisms of resistance in epidermal growth factor receptor-mutant lung adenocarcinomas. Eur Respir Rev 2014;23:356-366.
- Douillard J, Ostoros G, Cobo M, et al. Efficacy, safety and tolerability results from a phase 1V, open-label, single arm study of 1st-line gefitinib in Caucasian patients (pts) with epidermal growth factor receptor (EGFR) mutation-positive non-small cell lung cancer (NSCLC). Lung Cancer 2013;80:S31.
- Duffield EL, Watkins CL, Armour AA, Fukuoka M. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. New Engl J Med 2009;361:947-957.
- Goss G, Yang JCH, Ahn MJ, et al. AZD9291 in pre-treated patients with T790M positive advanced non-small cell lung cancer (NSCLC): pooled analysis from two Phase II studies. Presented at European Cancer Congress 2015 in Vienna, Austria on September 25-29, 2015. Abstract P365.
- Gerber DE, Gandhi L, Costa DB. Management and future directions in non-small cell lung cancer with known activating mutations. Am Soc Clin Oncol Educ Book 2014:e353-365.
- Hata A, Katakami N, Yoshioka H, et al. Spatiotemporal T790M heterogeneity in individual patients with EGFR-mutant non-small-cell lung cancer after acquired resistance to EGFR-TKI. J Thorac Oncol 2015;10:1553-1559.
- Chan AB, Hughes BGM. Targeted therapy for non-small cell lung cancer: current standards and promise of the future. Transl Lung Cancer Res 2015A:36-54.
- Janne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell-lung cancer. N Engl J Med 2015;372:1689-1699.
- Lopez-Rios F, Angulo B, Gomez B. Comparison of molecular testing methods for the detection of EGFR mutations in formalin-fixed paraffin-embedded tissue specimens of non-small cell lung cancer. J Clin Pathol 2013;66:381-385.
- Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004;350:2129-2139.
- Mok TS, Wu YI, Ahn MJ, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629-640.
- Soria JC, Ohe Y, Vansteenkiste J, et al.; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378:113-125.
- Morgensztern D, Campo MJ, Dahlberg SE, et al. Molecularly targeted therapies in non-small-cell lung cancer annual update 2014. J Thorac Oncol 2015;10(Suppl 1):S1-S63.
- Park K, Tan EH, Zhang L, et al. Afatinib (A) vs gefitinib (G) as first-line treatment for patients (pts) with advanced non-small cell lung cancer (NSCLC) harboring activating EGFR mutations: results of the global, randomized, open-label. Phase IIb trial LUX-Lung 7 (LL7). ESMO Asia 2015, Abstract LBA2_PR (20. 12. 2015).
- Penzel R, Sers C, Chen Y. EGFR mutation detection in NSCLC—assessment of diagnostic application and recommendations of the German Panel for Mutation Testing in NSCLC. Virchows Arch 2011;458:95-98.
- Ramalignam S, Yang JC, Lee CK, et al. Osimertinib as first-line treatment for EGFR mutation-positive advanced NSCLC: update efficacy and safety results from two phase 1 expansion cohorts. Presented at: 2016 European Lung Cancer Conference; April 13-16. 2016; Genewa, Switzerland. Abstract LB 01.
- Ramalingam S, Reungwetwattana T, Chewaskulyong B, et al. Osimertinib vs standard of care (SoC) EGFR-TKI as first-line therapy in patients (pts) with EGFRm advanced NSCLC: FLAURA. Presented at: 2017 ESMO Congress; Madrid, Spain; September 9-12, 2017. Abstract LBA2_PR.
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012;13:239-246.
- Wirth SM. Afatinib in non-small cell lung cancer. J Adv Pract Oncol 2015;6:448-455.
- Sequist LV, Soria JC, Camidge DR. Update to rociletinib data with the RECIST confirmed response rate. N Engl J Med 2016;374:2296-2297.
- Havel L. Tyrozinkinazové inhibitory EGFR třetí generace cílící na mutaci T790M v léčbě nemalobunečného karcinomu plic. Onkol Revue 2018;5:1-9.
- Shepherd FA, Pereira JR, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005;353:123-132.
- Skřičková J, Bortlíček Z, Hejduk K, et al. Gefitinib in front line treatment of patients with NSCLC in the Czech Republic: Analysis of 113 patients. Eur Respir J 2014;44:1-1.
- Skřičková J, Kadlec B, Venclíček O. Nemalobuněčný karcinom plic. Vnitřní Lék 2017;63:861-874.
- Tan CS, Giligan D, Pacey S. Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer. Lancet Oncol 2015;16:e447-459.
- Wieduwilt MJ, Moasser M. The epidermal growth factor receptor family: Biology driving targeted therapeutics. Cell Mol Life Sci 2008;65:1566-1584.
- Wu Y, Zhou C, Hu CP, et al. LUX-Lung 6: A randomized, open-label, phase III study of afatinib (A) versus gemcitabine/cisplatin (GC) as first-line treatment for Asian patients (pts) with EGFR mutation-positive (EGFR M+) advanced adenocarcinoma of the lung. J Clin Oncol 2013;31(5_suppl):8016-8016.
- Wu YL, Cheng Y, Zimou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation -positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 2017;18:1454-1466.
- Yang TCH, Schuler M, Yamamoto N, et al. LUX-Lung 3: a randomized, open-label, phase III study of afatinib vs cisplatin/pemetrexed as 1st-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations. J Clin Oncol 2012;30(suppl; abstr 14).
- Yang JCH, Sequist LV, Schuler MH, et al. Overall survival (OS) in patients (pts) with advanced non-small cell lung cancer (NSCLC) harboring common (Del19/L858R) epidermal growth factor receptor mutations (EGFR mut): Pooled analysis of two large open-label phase III studies (LUX-Lung 3 [LL3] and LUX-Lung 6 [LL6]) comparing afatinib with chemotherapy (CT). J Clin Oncol 2014;32(15_suppl):8004-8004.
- Yang JC, Ahn MJ, Kim DW, et al. Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017;35:1288-1296.
- Yu HA, Arcila ME, Rekhtman N, et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013;19:2240-2247.
- Zhang X, Zhao Y, Wang, et al. Detection and comparison of epidermal growth factor receptor mutations in cells and fluid of malignant pleural effusion in non-small cell lung cancer. Lung Cancer 2008;60:175-182.