Chronická myeloidní leukemie – potřebujeme ještě nové inhibitory tyrosinkináz?
Supplementum 01/2023
MUDr. Petra Čičátková; MUDr. Tomáš Horňák; Mgr. Tomáš Jurček, Ph.D.; doc. MUDr. Daniela Žáčková, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN Brno
SOUHRN
Asciminib je nejnovějším zástupcem z portfolia inhibitorů tyrosinkináz určených k terapii chronické myeloidní leukemie. Působí unikátním mechanismem prostřednictvím vazby do myristoylové kapsy ABL1 s následnou změnou konformace kinázy BCR::ABL1 na neaktivní. Odlišný mechanismus účinku může představovat výhodu v případě nedostatečné účinnosti inhibitorů tyrosinkináz působících cestou ATP-vazebné domény, a také se očekává příznivý profil nežádoucích účinků. Níže je představen případ pacientky profitující z užívání asciminibu nejen ve smyslu dosažení hluboké molekulární odpovědi, ale také s dobrou kvalitou života.
Klíčová slova
chronická myeloidní leukemie, inhibitory tyrosinkináz, asciminib
SUMMARY
Asciminib is the newest tyrosine kinase inhibitor used for chronic myeloid leukemia patients' therapy. Asciminib binds a myristoyl pocket of the BCR::ABL1, locking BCR::ABL1 into an inactive conformation. A different mechanism of action may be an advantage in the case of TKIs' acting via the ATP-binding domain failure, and a favorable side effect profile is expected. The following case report describes a chronic myeloid leukemia patient benefitting from the use of asciminib not only by means of achieving a deep molecular response but also of a good quality of life.
Key words
chronic myeloid leukemia, tyrosine kinase inhibitors, asciminib
ÚVOD
Terapie chronické myeloidní leukemie (chronic myeloid leukemia, CML) se posledních více než dvacet let opírá o inhibitory tyrosinkináz (tyrosine kinase inhibitor, TKI) namířené proti kináze BCR::ABL1, která hraje klíčovou roli v patogenezi CML.1 První ze skupiny TKI imatinib vedl k revoluci v terapii CML v podobě prodloužení očekávané délky života pacientů s nově diagnostikovaným onemocněním v chronické fázi na roveň zdravých vrstevníků a významného zlepšení prognózy s celkovým desetiletým přežitím pacientů ve studii IRIS (International Randomized Study of Interferon and STI571) téměř 84 %.2,3 Revoluční lék byl následován j eště účinnějšími TKI 2. a 3. generace - nilotinibem, dasatinibem, bosutinibem a ponatinibem, jejichž význam podtrhuje také fakt, že ve studii IRIS užívala imatinib 10 let od zahájení terapie CML méně než polovina pacientů ať už z důvodu nesnášenlivosti, či nedostatečné odpovědi na terapii.3-7
Asciminib je nejen nejmladším z portfolia TKI, ale je také unikátní svým mechanismem účinku. Nepůsobí cestou ATP-vazebné domény na rozdíl od výše zmíněných TKI, ale jako alosterický inhibitor se váže do myristoylové kapsy ABL1 s následnou změnou konformace BCR::ABL1 napodobující vlastnosti fyziologického ABL1, a řadí se tak mezi tzv. STAMP (Specifically Targeting the ABL1 Myristoyl Pocket) inhibitory.8 Odlišný mechanismus účinku může představovat výhodu v případě nedostatečné účinnosti TKI působících cestou ATP-vazebné domény, a také se, vzhledem k velmi specifickému působení, očekává lepší profil nežádoucích účinků (NÚ). Recentně byly publikovány aktualizované výsledky studie fáze III ASCEMBL, porovnávající účinnost a bezpečnost asciminibu v dávce 40 mg 2x denně s 500 mg bosutinibu denně u pacientů s CML v chronické fázi po předchozím selhání či při nesnášenlivosti nejméně dvou TKI. Byly potvrzeny výsledky primární analýzy ukazující na statisticky významnou převahu v podílu dosažených velkých molekulárních odpovědí (major molecular response [MMR], tj. pokles hladiny transkriptu BCR::ABL1 ≤ 0,1 % ve vztahu k mezinárodní škále [International Scale, IS]) ve prospěch asciminibu. Po 96 týdnech sledování dosáhlo MMR 37,6 % pacientů léčených asciminibem v porovnání s 15,8 % pacientů léčených bosutinibem a v rameni s asciminibem bylo také vyšší zastoupení pacientů, kteří dosáhli hluboké molekulární odpovědi na úrovni MR4.0 (odpovídá hladině transkriptu BCR::ABL1 ≤0,01 % ve vztahu k IS) - 17,2 % vs. 10,5 %. Byla také znovu potvrzena bezpečnost asciminibu v podobě nižšího podílu NÚ při terapii asciminibem - 91,0 % vs. 97,4 %, nižšího podílu závažných (stupeň 3 a 4) NÚ - 56,4 vs. 68,4 % a zejména méně častého přerušení terapie právě na vrub intolerance - 7,7 % vs. 23,6 %. Při léčbě asciminibem se nejčastěji vyskytovala bolest hlavy (19,9 %), únava (14,7 %), arteriální hypertenze (13,5 %), artralgie a průjem (shodně 12,8 %), který byl nejčastějším NÚ při terapii bosutinibem a komplikoval léčbu u 72,4 % pacientů. Další nežádoucí účinky provázející léčbu bosutinibem zahrnovaly nauzeu (46,1 %) a zvracení (26,3 %), bolesti břicha a hlavy (shodně 15,8 %) a únavu (9,2 %).9 Cévní NÚ provázející léčbu zejména ponatinibem a nilotinibem, jak bylo v minulosti prezentováno i v českém písemnictví, se vyskytly v obou ramenech raritně (5,1 % v rameni s asciminibem vs. 1,3 % v rameni s bosutinibem).9,10 Další zkušenosti s asciminibem ukazují data z klinických studií i každodenní praxe, jak bylo nedávno přehledně shrnuto i v českém písemnictví.8,9,11-18 Využití asciminibu v klinické praxi odráží i popis případu pacientky léčené na našem pracovišti.
POPIS PŘÍPADU
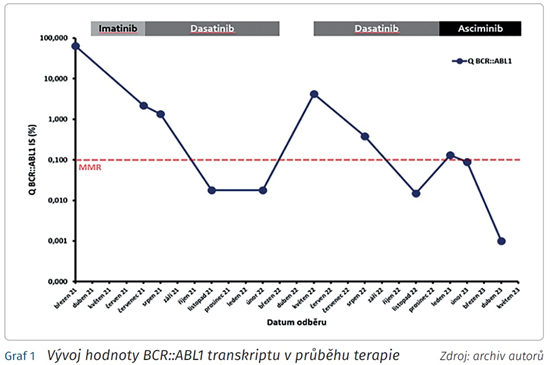
Pacientka ve věku 69 let byla referována na naše pracoviště v březnu 2021 pro náhodně zjištěnou leukocytózu. Na základě dalších vyšetření a potvrzené pozitivity BCR::ABL1 jí byla stanovena diagnóza CML v chronické fázi a byla zařazena do kategorie středního rizika jak podle Sokalova, tak i ELTS (EUTOS long-term survival) skóre. Anamnéza zahrnovala arteriální hypertenzi, dyslipidemii, autoimunitní hypothyreózu a prodělanou cévní mozkovou příhodu. Po krátké době podávání cytoredukce byla v dubnu 2021 zahájena terapie imatinibem v dávce 400 mg denně. Již od prvních dnů užívání se u pacientky objevil exantém obličeje stupně 2 podle Common Terminology Criteria for Adverse Events (CTCAE) verze 5.0 a také dyspepsie a nevolnost stupně 2, vyžadující jednak symptomatickou terapii, jednak snížení dávky imatinibu. Během prvního měsíce užívání byla navíc pacientka hospitalizována pro akutní infarkt myokardu na interním oddělení, což však nedáváme do souvislosti s užívaným TKI. Doprovodná medikace, užívání imatinibu večer a ani další redukce dávky nevedly k významnému zlepšení stavu, terapie imatinibem byla tedy ukončena. Současně s vysazením imatinibu uběhly tři měsíce od zahájení léčby TKI, kdy odpověď na terapii byla i přes časnou redukci dávky optimální, jak ukazuje graf 1.
Vzhledem k recentně proběhlému infarktu myokardu a anamnéze dyslipidemie a cévní mozkové příhody nebyl do druhé linie vhodný nilotinib, pacientka tedy zahájila v srpnu 2021 terapii dasatinibem v redukované dávce 60 mg denně pro předchozí intoleranci. Lék byl výborně tolerován, předchozí gastrointestinální toxicita, která byla hlavní příčinou vysazení imatinibu, se již znovu neobjevila, a po třech měsících terapie dasatinibem pacientka v listopadu 2021 dosáhla MMR. Při kontrole po šesti měsících terapie se však nově objevila hematologická toxicita – anemie a trombocytopenie stupně 1 a neutropenie stupně 2 - a na to konto byla terapie dále redukována na 40 mg denně. Po sedmi měsících terapie v březnu 2022 se u pacientky i přes významně redukovanou dávku objevila námahová dušnost a provedený RTG hrudníku potvrdil pleurální výpotek 2. stupně závažnosti. Užívání dasatinibu bylo přerušeno a pacientce byl podán furosemid podle doporučení plicního specialisty. Několikatýdenní přerušení dasatinibu bylo bohužel také spojeno se ztrátou MMR a nárůstem transkriptu na 4,2 %.
Léčba dasatinibem byla obnovena v květnu 2022 ve významně snížené dávce 20 mg denně a u pacientky byly zvažovány další terapeutické možnosti pro případ konfirmace ztráty MMR či recidivy fluidothoraxu. Nilotinib ani ponatinib nebyly vhodné vzhledem k jejich cévním NÚ a prodělanému infarktu myokardu a cévní mozkové příhodě v anamnéze pacientky, u bosutinibu je zase zvýšené riziko tvorby pleurálních výpotků. V té době byl v České republice k dispozici nový TKI asciminib dostupný cestou specifického léčebného programu. Přestože v listopadu 2022 byla obnovena MMR, při další návštěvě došlo znovu k její ztrátě a pacientka začala v lednu 2023 užívat asciminib v dávce 40 mg 2x denně. Od zahájení této terapie následovaly další dvě návštěvy na našem pracovišti, které potvrdily velmi dobrou toleranci léku bez klinických i hematologických NÚ, stejně jako výbornou léčebnou odpověď, kdy po jednom měsíci terapie bylo dosaženo MMR a po třech měsících terapie dokonce poprvé za celou dobu léčby také hluboké molekulární odpovědi na úrovni MR4.0, jak ukazuje graf 1.
DISKUSE A ZÁVĚR
Přestože CML je onemocnění spojené s excelentní prognózou, NÚ mohou představovat obtížně řešitelný problém a léčba je modifikována také komorbiditami pacienta. Jak ukázal případ prezentované pacientky, její komorbidity ji diskvalifikovaly z terapie nilotinibem či ponatinibem a i NÚ významně modifikovaly průběh samotné léčby. Přestože imatinib je obvykle velmi dobře tolerován a je vhodný i k léčbě starších a komorbidních pacientů, exantém se při jeho podávání vyskytuje často a většinou je zvládnutelný lokální terapií či redukcí dávky. Důvodem k vysazení imatinibu byla u prezentované pacientky především gastrointestinální toxicita, která velmi narušovala její kvalitu života. Pleurální výpotky jsou NÚ specifickým pro dasatinib, frekvence výskytu se pohybuje mezi 14 a 35 %, jejich výskyt narůstá s dobou terapie a také je závislý na dávce. S redukovanou dávkou je popisován méně častý výskyt fluidothoraxů, u naší pacientky se však objevil i přes dávku významně redukovanou. Naproti tomu asciminib, působící cestou vazby do myristoylové kapsy ABL1, má příznivý profil NÚ v porovnání s ostatními TKI a ukázal se v již zmíněné studii ASCEMBL poměrně bezpečným lékem a například pleurální výpotky v této studii nebyly vůbec popisovány.9 Absenci závažné toxicity léku naznačuje také prezentovaná kazuistika. U naší pacientky se při terapii asciminibem doposud nejen nevyskytly žádné NÚ, ale také byla velmi rychle navozena jak MMR, tak dokonce i hluboká molekulární odpověď. Vzhledem ke krátké době sledování je však nutná zdrženlivost při tvorbě závěrů a k definitivnímu zhodnocení účinnosti a bezpečnosti asciminibu je zapotřebí delší sledování jak naší pacientky, tak i dalších pacientů léčených v rámci studií i v prostředí každodenní klinické praxe.
Práce byla realizována za podpory Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1224/2022.
LITERATURA
- Bartram CR, de Klein A, Hagemeijer A, et al. Translocation fo c-abl oncogene correlates with the presence of a Philadelphia chromosome in chronic myelocytic leukaemia. Nature 1983;306:277-280.
- Bower H, Björkholm M, Dickman PW, et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol 2016;34:2851-2857.
- Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. N Eng J Med 2017; 379:917-927.
- Kantarjian HM, Huges TP, Larson RA, et al. Long-term outcomes with frontline nilotinib versus imatinib in newly diagnosed chronic myeloid leukemia in chronic phase: ENESTnd 10-year analysis. Leukemia 2021;35:440-453.
- Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-year study results of DASISION: The dasatinib versus imatinib study in treatment-Näive chronic myeloid leukemia patients trial. J Clin Oncol 2016;34:2333-2340.
- Brümmendorf TH, Cortes JE, Milojkovic D, et al. Bosutinib versus imatinib for newly diagnosed chronic phase chronic myeloid leukemia: final results from the BFORE trial. Leukemia 2022;36:1825-1833.
- Cortes JE, Kim DW, Pinila-Ibraz J, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood 2018;132:393-404.
- Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019;381:2351-2326.
- Hochhaus A, Rea D, Boquimpani C, et al. Asciminib vs bosutinib in chronic-phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer-term follow-up of ASCEMBL. Leukemia 2023;37:617-626.
- Čičátková P, Žáčková D, Horňák T, et al. Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi. Trasfuze Hematol Dnes 2023;29:29-37.
- Rea D, Mauro MJ, Boquimpani C, et al. A phase 3, open-label, randomized study of asciminib, a SATAMP inhibitor, vs. bosutinib in CML after 2 or more prior TKIs. Blood 2021;138:2031-2041.
- Innes AJ, Hayden C, Orovboni V, et al. Real-world experience of asciminib: factors associated with response. Blood 2022;140(Suppl 1):6796-6797.
- Kockerols CCB, Janssen JJWM, Blijlevens NMA, et al. Treatment patterns and clinical outcomes of asciminib in a real-world multiresistant chronic myeloid leukemia patient population. Haematologica 2023:240-244.
- Shanmuganathan N, Hughes TP. Asciminib for chronic myeloid leukaemia: Next questions. Br J Haematol 2022;199:322-331.
- Laganà A, Scalzulli E, Carmosino I, et al. Asciminib as a third line option in chronic myeloid leukemia. Int J Hematol 2023;117:16-23.
- Čičátková P, Horňák T, Žáčková D. Chronická myeoliodní leukemie - aktuální léčebné možnosti. Farmakoterapie 2022;18(Suppl 2):8-15.
- Čičátková P, Žáčková D. Postavení inhibitorů tyrozinkináz v léčbě chronické myeloidní leukemie. Onkol Revue 2023:10:1-6.
- Horňák T, Čičátková P, Žáčková D. Asciminib - nová možnost v léčbě CML. Farmakoterapie. 2023;1:313-324.