Trastuzumab deruxtecan: silný hráč na poli metastazujícího HER2 pozitivního karcinomu prsu
01/2022
MUDr. Martina Zimovjanová, Ph.D.
Onkologická klinika 1. LF UK a VFN v Praze
SOUHRN
Prognóza nemocných s neresekovatelným či metastazujícím karcinomem prsu s pozitivitou receptoru 2 pro lidský epidermální růstový faktor (human epidermal growth factor receptor 2, HER2) se významně zlepšila zavedením nových anti-HER2 přípravků. Současným léčebným standardem je kombinace taxanů s pertuzumabem a trastuzumabem v první linii s následnou terapií trastuzumab emtansinem v druhé anti-HER2 linii. Možnosti léčby pokročilého HER2 pozitivního karcinomu prsu se stále rozvíjejí, k dispozici jsou další anti-HER2 přípravky, jako např. trastuzumab deruxtecan (fam-trastuzumab deruxtecan-nxki [DS-8201a]). Trastuzumab deruxtecan prokázal velmi slibné výsledky v klinických studiích DESTINY-Breast01 a DESTINY-Breast03. Cílem sdělení je prezentace výsledků klinických studií s trastuzumab deruxtecanem s návrhem algoritmu managementu léčby nemocných s HER2 pozitivním pokročilým karcinomem prsu podle nejaktuálnějších mezinárodních doporučení.
Klíčová slova
HER2 pozitivní karcinom prsu, konjugáty protilátky a cytostatika, trastuzumab deruxtecan (T-DXd), intersticiální plicní choroba
SUMMARY
The prognosis of patients with unresectabie or metastatic HER2 positive breast cancer has greatly improved after the introduction of new anti-HER2 drugs beyond trastuzumab. For most patients, a taxane combined with trastuzumab and pertuzumab in the first-line setting, followed by trastuzumab-emtansine in second line, should be considered the standard of the care today. The treatment landscape of HER2-positive advanced disease is evolving constantly, several emerging anti-HER2 therapies are becoming available, including trastuzumab deruxtecan (fam-trastuzumab deruxtecan-nxki [DS-8201a]). Trastuzumab deruxtecan (T-DXd) proved promising results in clinical studies DESTINY-BreastOI and Destiny-Breast03. Here, we provide an overview of results of clinical studies with T-DXd and of the current and future management of HER2-positive advanced breast cancer.
Key words
HER2 positive breast cancer, antibody drug conjugates, trastuzumab deruxtecan (T-DXd), interstitial lung disease
ÚVOD
U 15-20 % pacientek s metastazujícím karcinomem prsu je prokázána overexprese nebo amplifikace receptoru pro humánní epidermální růstový faktor (HER2).1-3 Doporučenou terapií v první linii u HER2 pozitivního metastazujícího karcinomu prsu je podání anti-HER2 monoklonálních protilátek trastuzumabu a pertuzumabu v kombinaci s chemoterapií s taxany. Ve studii CLEOPATRA léčebná kombinace trastuzumab, pertuzumab a docetaxel dosáhla mediánu přežití bez progrese onemocnění (progression free survival, RFS) 18,7 měsíce a celkového přežití (overall survival, OS) 56,5 měsíce.4,5 Jako standardní druhá linie léčby je podáván konjugát protilátky a cytostatika trastuzumab emtansinu (T-DM1), který dosahuje 43,6 % léčebných odpovědí s mediánem RFS 9,6 měsíce, pokud je léčba podávána po terapii trastuzumab a taxan.6 V dalších liniích terapie HER2 pozitivního metastazujícího karcinomu prsu nejsou stanovena jednotná doporučení, dostupné léčebné možnosti dosahují pouze krátkodobějších léčebných odpovědí u 9-31 % nemocných a RFS v trvání 3-6 měsíců ve třetí a vyšší linii léčby.7-10. Terapie pacientů s neresekovatelným nebo metastazujícím HER2 pozitivním karcinomem prsu tak zůstává nadále výzvou. Především nové konjugáty protilátky s cytostatikem představují velmi slibnou možnost terapie předléčených nemocných s neresekovatelným nebo metastazujícím HER2 pozitivním karcinomem prsu.
TRASTUZUMAB DERUXTECAN: MECHANISMUS ÚČINKU
Trastuzumab deruxtecan (T-DXd) je konjugát protilátky cílené na HER2 receptor a cytotoxického přípravku. Humanizovaná monoklonální protilátka anti-HER2 imunoglobulin G1 (IgG1) je navázána kovalentní vazbou na deruxtecan (DXd) - inhibitor topoizomerázy 1 pomocí štěpitelného můstku založeného na tetrapeptidu. Ke každé molekule protilátky je připojeno 8 molekul deruxtecanu.11 Po navázání na receptor HER2 podstupuje komplex trastuzumab deruxtecan internalizaci a štěpení intracelulárního můstku lysosomálními enzymy. Po uvolnění způsobuje DXd poškození DNA a apoptickou smrt buněk. Deruxtecan, derivát exatecanu, je přibližně 10krát účinnější než SN-38, aktivní metabolit irinotecanu. Na rozdíl od trastuzumab emtansinu je trastuzumab deruxtecan schopen jednoduše přestoupit buněčnou membránu a uvolnit cytostatikum, což pravděpodobně způsobuje cytotoxický efekt na okolní buňky bez závislosti na HER2 expresi (bystander effect).12
STUDIE DESTINY-BREAST01
Trastuzumab deruxtecan byl hodnocen v klinické studii DESTINY-Breast01 - multicentrické, otevřené studii fáze 2 zkoumající dávku a účinnost T-DXd u pacientek s neoperovatelným nebo metastazujícím karcinomem prsu, které podstoupily dvě nebo více linií anti-HER2 léčby zahrnující trastuzumab emtansin (100 %), trastuzumab (100 %) a pertuzumab (65,8 %). První fáze studie stanovila terapeutickou dávku T-DXd 5,4 mg/kg, druhá fáze pak zkoumala účinnost a bezpečnost této léčby. Rrimárním cílem bylo vyhodnocení objektivní léčebné odpovědi (objective response rate, ORR), klíčovými sekundárními cíli byly: míra kontroly nemoci (disease control rate, DCR), míra klinického přínosu (clinical benefit rate, CBR), trvání odpovědi (duration of response, DoR), doba přežití bez progrese (progression free survival, RFS), celkové přežití (overall survival, OS) a bezpečnost terapie. Do studie nebyly zahrnuty pacientky s anamnézou léčené intersticiální plicní choroby (interstitial lung disease, ILD) nebo s ILD/pneumonitidy při screeningu, pacientky s neléčenými nebo symptomatickými metastázami centrálního nervového systému (CNS) a pacientky s anamnézou klinicky významného srdečního onemocnění. Zařazené pacientky měly alespoň jednu měřitelnou lézi podle kritérií hodnocení odpovědí u solidních nádorů (RECIST 1.1).
Přípravek trastuzumab deruxtecan byl podáván formou intravenózní infuze v dávce 5,4 mg/kg hmotnosti jednou za tři týdny až do progrese onemocnění, úmrtí, stažení souhlasu nebo neakceptovatelné toxicity. Primárním parametrem účinnosti byla potvrzená objektivní míra odpovědi v populaci podle léčebného záměru (intention to treat population, ITT), hodnocená nezávislým centrálním hodnocením. Sekundárním parametrem účinnosti bylo trvání odpovědi.
U 184 pacientek zařazených do studie DESTINY-BreastOl byly výchozí demografické a anamnestické údaje následující: medián věku 55 let (rozmezí 28-96 let); 23,9 % žen bylo ve věku ≥ 65 let; ve 100 % byly léčeny ženy. Status výkonnosti (performance status, PS) podle Eastern Cooperative Oncology Group (ECOG) 0 (55,4 %), ECOG PS 1 (44,0 %); status hormonálních receptorů (pozitivní: 52,7 %); přítomnost viscerálního onemocnění (91,8 %); dříve léčené a stabilní metastázy mozku (13,0 %); medián počtu předchozích terapií při metastazujícím onemocnění: 5 (rozmezí: 2-17); suma průměrů cílových lézí (< 5 cm: 42,4 %; ≥ 5 cm: 50,0 %).
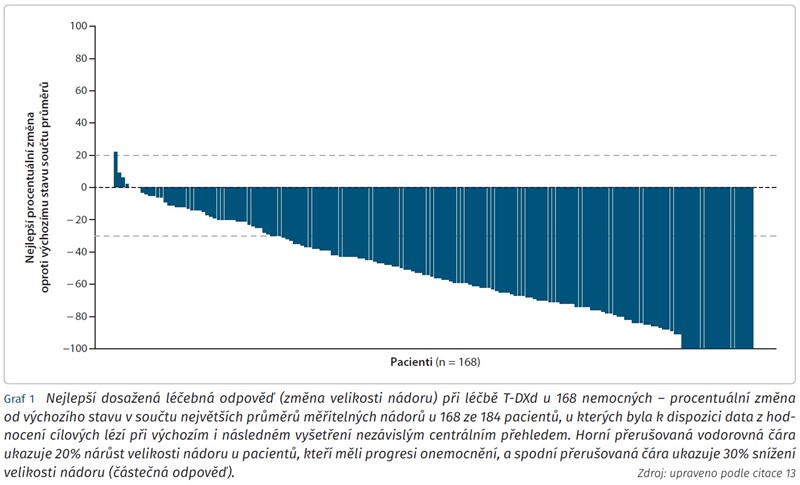
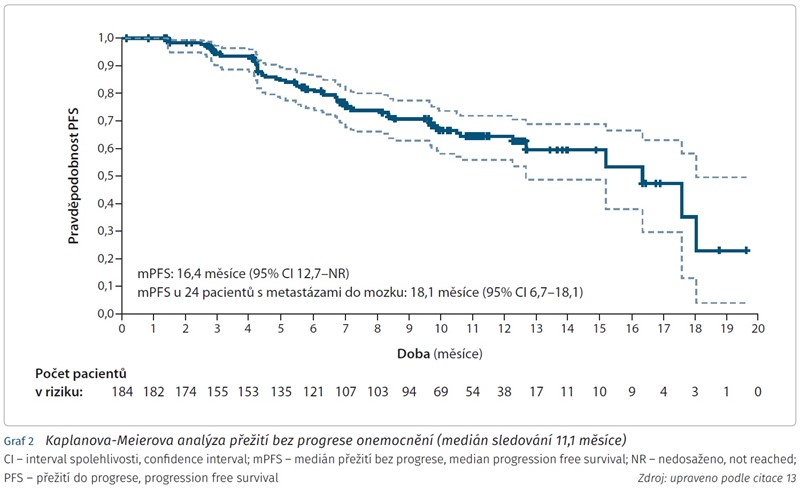
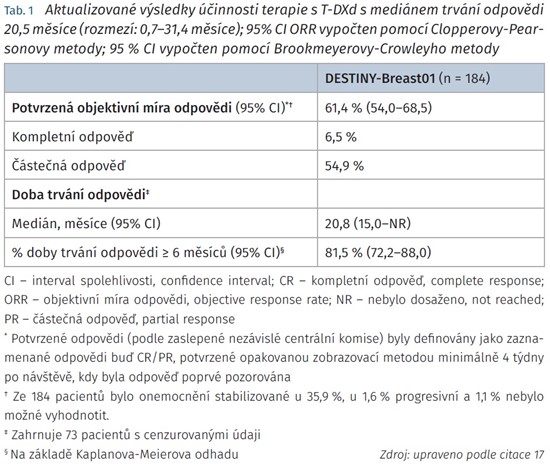
Při mediánu sledování 11,1 měsíce byla prokázána objektivní léčebná odpověď u 60,9 % pacientek (95 % interval spolehlivosti [confidence interval, CI] 53,4-68,0) s 6,0 % kompletních odpovědí a 54,9 % částečných odpovědí CI (graf 1 a 2). U 36,4 % nemocných byla zaznamenána stabilizace choroby, pouze u 1,6 % pacientek byla prokázána progrese onemocnění. Medián trvání léčebné odpovědi dosáhl 14,8 měsíce (95 % CI 13,8-16,9), u 81,3 % nemocných bylo zaznamenáno trvání léčebné odpovědi ≥ 6 měsíců (95 % CI 71,9-87,8).13 V rámci předem specifikovaných podskupin byla konzistentně pozorována protinádorová aktivita i u nemocných předléčených pertuzumabem, účinnost T-DXd byla také prokázána bez rozdílu v expresi hormonálních receptorů.
Na kongresu San Antonio Breast Cancer Symposium (SABCS) 2020 byla publikována druhá analýza dat studie. U 61,4 % pacientek (95 % CI 54,0-68,5 %) byla dokumentována odpověď na léčbu s mediánem trvání 20,8 měsíce (95 % CI 15,0 měsíců - nelze stanovit [not evaluable, NE]) a s mediánem PFS 19,4 měsíce (95 % CI 14,1 měsíců - NE).14 U většiny pacientek bylo v rámci čtení nezávislou komisí zaznamenáno snížení nádorové nálože (tab. 1).
V rámci analýzy OS přežívalo 85 % pacientek (95 % CI 79-90 %) ve 12 měsících a 74 % nemocných (95 % CI 67-80 %) v 18 měsících. Trastuzumab deruxtecan vykazoval příznivý bezpečnostní profil. Většina pacientek užívala léčbu v původním dávkování a bez přerušení. Nejčastějšími nežádoucími účinky byly nevolnost, únava a alopecie. Z nežádoucích účinků vyžadujících zvláštní pozornost byla zaznamenána ILD u 13,6 % nemocných v prvním čtení a 15,4 % v druhém čtení. U 4 pacientek (2,2 %) byla dokumentována velmi závažná ILD (G4-G5) s fatálními důsledky. Toxicita ve vztahu k ILD se nejevila kumulativní vzhledem k nízké frekvenci vývoje ILD po jednom roce léčby. Nebyla zaznamenána významná incidence kardiotoxických událostí. Byly hlášeny jen čtyři případy (2,2 %) významného poklesu ejekční frakce levé komory a dva případy (1,1 %) srdečního selhání.
 U nemocných léčených trastuzumab deruxtecanem mají být pečlivě sledovány známky a příznaky ILD/pneumonitidy, které se nejčastěji projevují kašlem, ztíženým dýcháním a horečkou. Nemocné s podezřením na ILD/pneumonitidu mají být vyšetřeny rentgenologicky, přednostně výpočetní tomografií. Je třeba zvážit konzultaci s pneumologem. V případě asymptomatické (stupeň 1) ILD/pneumonitidy lze zvážit léčbu kortikosteroidy (prednisolon v dávce ≥ 0,5 mg/kg hmotnosti). Léčba trastuzumab deruxtecanem se má pozastavit až do zotavení na stupeň 0. V případě symptomatické ILD/pneumonitidy (stupeň 2 nebo vyšší) je nutno okamžitě zahájit léčbu kortikosteroidy (např. prednisolon v dávce ≥ 1 mg/kg nebo vhodný ekvivalent) a pokračovat po dobu alespoň 14 dní nebo do úplného vymizení klinických nálezů a nálezu na výpočetní tomografii hrudníku. Dávka kortikoterapie se postupně redukuje po dobu alespoň 4 týdnů. Léčba trastuzumab deruxtecanem se má trvale ukončit u pacientů s diagnózou jakékoli symptomatické (stupeň 2 nebo vyšší) ILD/pneumonitidy.
U nemocných léčených trastuzumab deruxtecanem mají být pečlivě sledovány známky a příznaky ILD/pneumonitidy, které se nejčastěji projevují kašlem, ztíženým dýcháním a horečkou. Nemocné s podezřením na ILD/pneumonitidu mají být vyšetřeny rentgenologicky, přednostně výpočetní tomografií. Je třeba zvážit konzultaci s pneumologem. V případě asymptomatické (stupeň 1) ILD/pneumonitidy lze zvážit léčbu kortikosteroidy (prednisolon v dávce ≥ 0,5 mg/kg hmotnosti). Léčba trastuzumab deruxtecanem se má pozastavit až do zotavení na stupeň 0. V případě symptomatické ILD/pneumonitidy (stupeň 2 nebo vyšší) je nutno okamžitě zahájit léčbu kortikosteroidy (např. prednisolon v dávce ≥ 1 mg/kg nebo vhodný ekvivalent) a pokračovat po dobu alespoň 14 dní nebo do úplného vymizení klinických nálezů a nálezu na výpočetní tomografii hrudníku. Dávka kortikoterapie se postupně redukuje po dobu alespoň 4 týdnů. Léčba trastuzumab deruxtecanem se má trvale ukončit u pacientů s diagnózou jakékoli symptomatické (stupeň 2 nebo vyšší) ILD/pneumonitidy.
STUDIE DESTINY-BREAST03
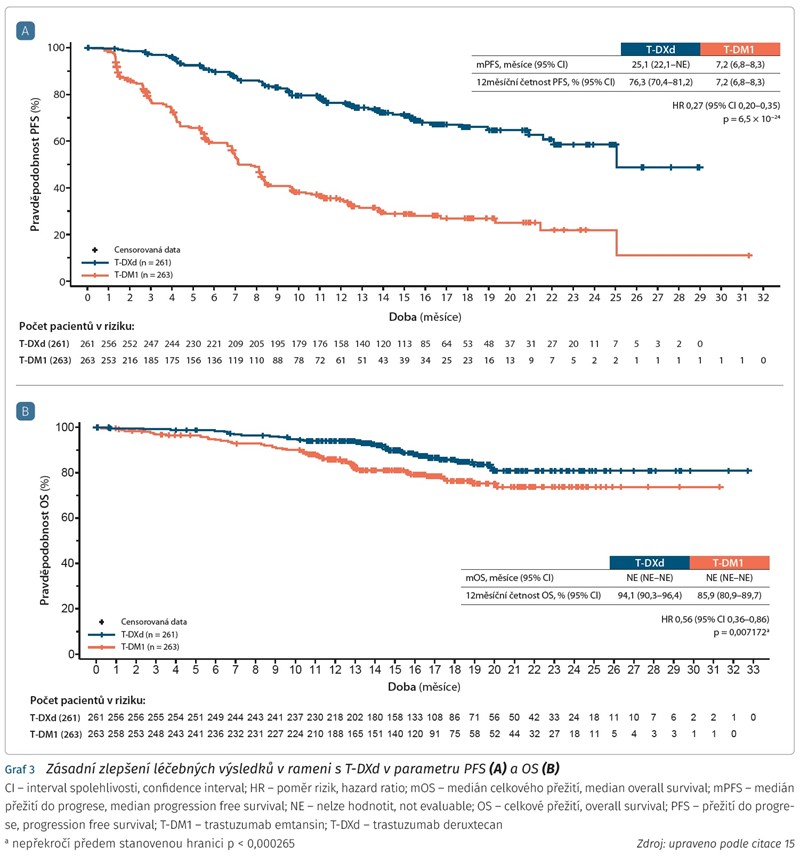
Na letošním virtuálním kongresu ESMO 2021 byly publikovány výsledky randomizované, multicentrické, otevřené studie fáze III DESTINY-Breast03. Primárním cílem studie bylo vyhodnocení PFS u pacientek v rameni s trastuzumab deruxtecanem oproti léčbě s trastuzumab emtansinem; sekundárními cíli bylo vyhodnocení OS, DoR, ORR a bezpečnosti léčby. Do studie bylo zařazeno 524 nemocných s neresekovatelným nebo metastazujícím HER2 pozitivním karcinomem prsu, které byly předléčeny trastuzumabem a taxany v adjuvantním podání nebo v případě metastazujícího onemocnění. Výchozí demografické a anamnestické údaje byly následující: medián věku 54 let (rozmezí 20-93 let); ECOG PS 0 (59,0 %), ECOG 1 (40,6 %); status hormonálních receptorů (pozitivní: 50,2 %); přítomnost viscerálního onemocnění (70,5 %); dříve léčené a stabilní metastázy mozku (23,8 % v rameni s T-DXd). 70 % nemocných bylo léčeno 1-2 liniemi předchozí anti-HER2 léčby, 99,7 % bylo předléčeno trastuzumabem a 62,1 % i pertuzumabem. V rameni s T-DXd bylo dosaženo zásadního prodloužení přežití bez progrese onemocnění (mPFS) 25,2 měsíce oproti 7,2 měsíce v rameni s trastuzumab emtansinem (HR 0,26; 95 % CI 0,20-0,35). Bez známek progrese onemocnění přežívá ve 12 měsících 73 % pacientek v rameni s T-DXd oproti 35 % v rameni s T-DM1 (graf 3).15
V rameni s T-DXd bylo pozorováno také více než zdvojnásobení léčebných odpovědí (ORR): 79,7 % oproti 34,9 % v rameni s T-DM1. Bezpečností profil obou konjugátů protilátky s cytostatikem byl srovnatelný. V této studii nebyla zaznamenána závažná ILD G4-G5 nebo významný pokles ejekční frakce levé komory. Nejčastějším důvodem pro ukončení léčby v rameni s T-DXd byla ILD/pneumonitida u 8,2 % nemocných, v rameni s T-DM1 trombocytopenie u 2,7 % pacientek.
Trastuzumab deruxtecan prokázal ve studii DESTINY-Breast03 statisticky signifikantní a klinicky velmi významné zlepšení v parametru PFS, redukci rizika progrese nebo úmrtí o 72 % oproti T-DM1 u předléčených nemocných pro pokročilý HER2 pozitivní karcinom prsu. Zlepšení léčebných výsledků v parametru PFS je konzistentní ve všech podskupinách nemocných, data OS zatím nejsou zralá.
ZÁVĚR
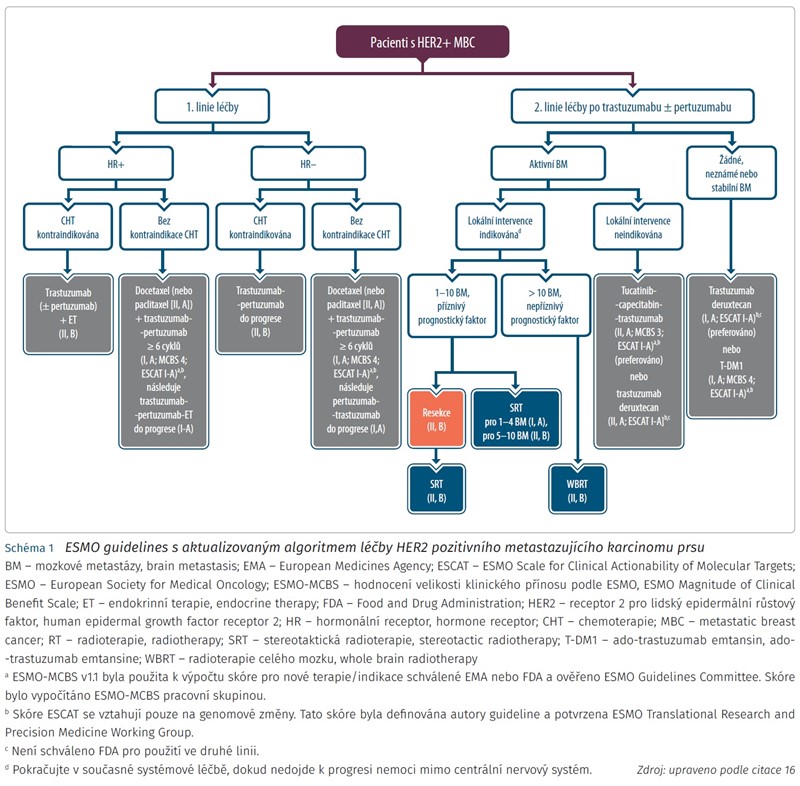
Konjugát HER2 protilátky s cytostatikem - trastuzumab deruxtecanem - byl schválen k použití Americkou lékovou agenturou (Food and Drug Administration, FDA 12/2020) i Evropskou lékovou agenturou ((European Medicines Agency, EMA 01/2021) a byl již implementován do mezinárodních doporučených postupů pro léčbu HER2 pozitivního karcinomu prsu. Trastuzumab deruxtecan je indikován k léčbě dospělých nemocných s neresekovatelným nebo metastazujícím HER2 pozitivním karcinomem prsu, které podstoupily dva nebo více režimů na bázi anti-HER2 léčby (v České republice zatím není stanovena standardní úhrada, je nutné schválení revizním lékařem pojišťovny). Na podkladě výsledků studií DESTINY-Breast01 a především DESTINY-Breast03 lze předpokládat, že se terapie T-DXd stane standardem druhé a vyšší linie léčby HER2 pozitivního metastazujícího karcinomu prsu, což již zohledňují aktuálně publikované ESMO guidelines z října 2021 (schéma 1).16 Jak významně změní trastuzumab deruxtecan algoritmy léčby karcinomu prsu, nám napoví další výsledky probíhajících klinických studií: např. DESTINY-Breast04 u tzv. HER2 low karcinomů prsu (imunohistochemická exprese HER2 definovaná jako 1+, HER2 2+), DESTINY-Breast09 srovnávající T-DXd oproti standardní léčbě první linie pertuzumab + trastuzumab + docetaxel a studie DESTINY-Breast05, která srovnává účinnost T-DXd oproti T-DM1v postneoadjuvantní léčbě u pacientek s reziduální chorobou u časného HER2 pozitivního karcinomu prsu.
LITERATURA
- Gonzalez-Angulo AM, Litton JK, Broglio KR, et al. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor2-positive, node-negative tumors 1 cm or smaller. J Clin Oncol 2009;27:5700-5706.
- Onitilo AA, Engel JM, Greenlee RT, Mukesh BN. Breast cancer subtypes based on ER/PR and Her2 expression: comparison of clinicopathologic features and survival. Clin Med Res 2009;7:4-13.
- Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987;235:177-82.
- Swain SM, Baselga J, Kim SB, et al. Pertuzumab, trastuzumab and docetaxel in HER2-positive breast cancer. N Engl J Med 2015;372:724-734.
- Swain S, Miles D, Kim SB, et al. End of study analysis from the phase III, randomized, double-blind, placebo (pla)- controlled CLEOPATRA study of first-line (1L) pertuzumab (P), trastuzumab (H) and docetaxel (D) in patients (pts) with HER2-positive metastatic breast cancer (MBC). J Clin Oncol 2019;37(15_suppl):1020-1020.
- Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367:178391.
- Geyer CE, Forster J, Lindquist D, et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006;355:2733-2743.
- Krop IE, Kim SB, Gonzalez-Martin A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 2014;15:68999.
- Rugo HS, ImSA, Write GLS, et al. SOPHIA primary analysis: a phase 3 study of margetuximab + chemotherapy in patients with HER2+ metastatic breast cancer after prior anti-HER2 therapies. J Clin Oncol 2019;37(15_Suppl):1000-1000.
- Saura C, Oliviera M, Feng YH, et al. Neratinib + capecitabine versus lapatinib + capecitabine in patients with HER2+ metastatic breast cancer previously treated with >2 HER2-directed regimens: findings from the multinational, randomised, phase III NALA trial. J Clin Oncol 2019;37(Suppl):1002-1002.
- Doi T, Shitara K, Naito Y, et al. Safety, pharmacokinetics, and antitumour activity of trastuzumab deruxtecan (DS-8201), a HER2-targeting antibody-drug conjugate, in patients with advanced breast and gastric or gastro-oesophageal tumours: a phase 1 dose-escalation study. Lancet Oncol 2017;18:1512-1522.
- Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM2. Clin Cancer Res 2016;22:50971081.
- Modi S, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020;382:610-621.
- Modi S, Saura C, Yamashita T, Park YH. Updated Results From DESTINY-Breast01, a phase 2 trial of trastuzumab deruxtecan (T-DXd) in HER2-positive metastatic breast cancer. SABCS20-PD3-06 Published December 8-11, 2020. Dostupné na: https://www.physiciansweekly.com/wp-content/uploads/2021/01/Modi_PD3- 06_DESTINY-Breast01.pdf
- Cortes J, Kim S, Chunget W, et al. Abstract LBA 1- Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (Pts) with HER2+ metastatic breast cancer (mBC): Results of the randomized phase III DESTINY-Breast03 study. Ann Oncol 2021;32(Suppl 5):S1283-S1346.
- Gennari A, Andre F, Barrios CH, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol 2021;32:1475-1495.
- SÜKL. SPC Enhertu [online]. Dostupné na: www.sukl.cz