Význam chirurgické léčby v onkogynekologii
06/2016
Jaroslav Klát
Porodnicko-gynekologická klinika FN Ostrava
SOUHRN
Primární chirurgická léčba u časných stadií gynekologických malignit má zásadní význam jak stagingový, tak léčebný, umožňující rozlišit pacientky s velmi nízkým rizikem recidivy onemocnění, u kterých může být upuštěno od adjuvantní léčby. V případě vyšších stadií má primární chirurgická léčba význam především u zhoubných nádorů ovaria, kdy velikost ponechaného nádorového rezidua má zásadní vliv na celkové přežití. Cílem operační léčby by tak mělo být nulové (mikroskopické) reziduum. To platí i pro chirurgickou léčbu recidiv gynekologických malignit. Extendované chirurgické výkony (resekční operace na kličkách střevních, splenektomie, resekce jater, odstranění peritonea bránice atd.) u pokročilých stadií/rekurence onemocnění vyžadují multioborovou spolupráci. Z dostupných dat jasně vyplývá, že nejlepší výsledky jsou u pacientek operovaných v onkogynekologických centrech.
KLÍČOVÁ SLOVA
karcinom ovaria, karcinom hrdla děložního, karcinom endometria, karcinom vulvy, primární chirurgická léčba, nádorové reziduum
SUMMARY
Completeness of the primary surgical staging in early-stage gynaecological cancers has strong impact on a prognosis and it could distinguish between low and high risk patiens for the reccurence of the disease. The prognostic value of complete debulking on overall survival has been confirmed, especially in advance-stage ovarian tumors. The goal of treamtent is to achieve no macroscopic residual disease. The same strategy of surgical treatment is applied in tumor recurrence. In patiens presenting with extensive metastatic tumor spread, complete tumor resection may require extensive upper abdominal surgery, including procedures such as diaphragm resection or peritonectomy, splenectomy, or partial liver resection. These extended surgical procedures require a multidisciplinary approach. The patiens being treated in onco-gynecological centers have higher chance to achieve complete tumor resection.
KEY WORDS
ovarian cancer, cervical cancer, endometrial cancer, surgical treatment, residual tumor
CHIRURGICKÁ LÉČBA ZHOUBNÝCH NÁDORŮ VULVY
Karcinomy vulvy jsou poměrně málo časté nádory s incidencí 4,9 na 100 000 žen (ÚZIS), vyskytující se především ve vyšších věkových kategoriích 7 a 8 decennia.
Chirurgická léčba zhoubných nádorů vulvy se začala rozvíjet ve 40. a 50. letech minulého století jako tzv. radikální „butterfly“ vulvektomie, odstraňující zevní rodidla a tkáň třísel včetně kůže, podkoží a lymfatických uzlin třísel en bloc. Tato operace přinesla vynikající lokální kontrolu nemoci a dlouhodobé přežití, avšak za cenu výrazných pooperačních komplikací. Proto byla koncem minulého století nahrazena tzv. radikální vulvektomií ze tří incizí, kdy jsou samostatně ovoidní incizí odstraněny zevní rodidla a dále z jednotlivých incizí pod tříselným vazem je provedena inguinofemorální lymfadenektomie. I přes tuto modifikaci zůstává vysoké procento pooperačních komplikací (rozpad rány, dehiscence třísle, lymfokély, lymfedémy a opakovaný erysipel). Proto se hledaly další cesty na snížení radikality. Jedna cesta směřuje k dalšímu omezení radikality chirurgického výkonu na zevních rodidlech, tak aby byla zachována alespoň částečně jako anatomicko-funkční celek. Radikální vulvektomie je tedy nahrazována buď v případě malých, anebo lateralizovaných nádorů radikální hemivulvektomií (přední, zadní, laterální), anebo pouze radikální excizí s ochranným lemem ve spojení s detekcí sentinelové uzliny, anebo se systematickou unilaterální/bilaterální inguinofemorální lymfadenektomií v závislosti na velikosti a lokalizaci nádoru. Druhá cesta se snaží omezit radikalitu na lymfatickém systému, a to nahrazením systematické lymfadenektomie konceptem sentinelové uzliny. V prospektivní multicentrické studii publikované Van Der Zeem bylo zahrnuto 259 pacientek s negativní sentinelovou uzlinou, u kterých nebyla provedena systematická lymfadenektomie (1). V následném sledování (medián 35 měsíců) došlo k recidivě nemoci v třísle pouze u 6 pacientek (2,3 %) a 3leté přežití (OS - overall survival) činilo 97 %. Statisticky významný pokles byl zaznamenán u časné pooperační morbidity v případě rozpadu rány třísla (11,7 vs. 34 %), z dlouhodobé morbidity pak došlo ke snížení opakujícího se erysipelu (0,4 vs. 16,2 %) a lymfedému končetiny (1,9 vs. 25,2 %). Bezpečnost tohoto konceptu byla potvrzena v roce 2012 také ve studii GOG274 (2). Při nálezu pozitivity sentinelové uzliny je však indikováno provedení systematické inguinofemorální lymfadenektomie (3). Snaha o nahrazení systematické inguinofemorální lymfadenektomie v případě pozitivity sentinelové uzliny pouze radioterapií vedla k zahájení prospektivní studie GROINSS-V-2/GOG270, která však ještě není ukončena.
Chirurgická léčba recidiv zhoubných nádorů vulvy
Z dostupných dat recentní prospektivní studie, zahrnující největší počet pacientek se známým statusem sentinelových uzlin, je incidence lokální recidivy nemoci v 5 letech 27,2 % a v 10 letech 39,5 % (4). Důležitou informací z této studie s 10letým follow-up je to, že ve skupině pacientek s negativní SLN došlo k recidivě nemoci v oblasti třísla pouze u 6 pacientek a to do 19 měsíců od léčby. V pozdějším období tento druh recidivy nebyl zaznamenán, a to na rozdíl od pacientek s pozitivní SLN, u kterých bylo procento recidiv v oblasti třísla v 5. a 10. roce 8,0 %. Metodou volby chirurgického řešení lokální recidivy na vulvě je široká excize, která je někdy spojena při opakovaných reexcizích s lalokovým přenosem tkáně ke krytí defektu. Vzhledem k věkové skupině pacientek se pouze ve výjimečných případech přistupuje k exenteraci pánve.
CHIRURGICKÁ LÉČBA ZHOUBNÝCH NÁDORŮ HRDLA DĚLOŽNÍHO
Zhoubné nádory hrdla děložního mají incidenci 21,9 na 100 000 žen (ÚZIS), na rozdíl od ostatních gynekologických zhoubných nádorů se vyskytují poměrně často i u mladších žen a jejich operační léčba tak s sebou přináší i otázky ohledně zachování fertility. Chirurgická léčba se týká pouze stadia FIGO la-IIa, při vyšších stadiích s postižením parametrií je primární volbou chemoradioterapie. Operační léčba se tak týká zhruba pouze 50 % pacientek.
V případě mikroinvazivních karcinomů bez přítomné lymfangioinvaze stadia FIGO IA1 je metodou volby neradikální operace, tzn. odstranění cervixu (konizace) u mladých žen, anebo hysterektomie bez provedení parametrektomie a lymfadenektomie u žen, které již neplánují těhotenství. U stadií FIGO IA1 s lymfagioinvazí, FIGO IA2 a IB1 (menší než 2 cm/s invazí méně než do / stromatu) je metodou volby radikální hysterektomie v radikalitě Querleu-Morrow B. Tato operace může být provedena abdominálně, laparovaginálně, laparoskopicky, anebo roboticky. V případě stadia FIGO IB1 nad 2 cm a stadia FIGO IB2 pak radikální hysterektomie v radikalitě Querleu-Morrow C. V našich podmínkách předchází operační léčbě u stadia FIGO IB2 neoadjuvantní chemoterapie (NAC) ke zmenšení volumu nádoru. Ta vede nejen ke zmenšení tumoru, ale také ke zmenšení počtu pozitivních lymfatických uzlin a tím ke snížení počtu indikovaných pacientek k adjuvantní radioterapii. Význam NAC na přežití však nebyl prokázán (5). Radikalita hysterektomií se liší rozsahem resekovaných parametrií. Radikální hysterektomie je doplněna systematickou pánevní lymfadenektomií. Zde je také uplatněn koncept sentinelové uzliny, přinášející zpřesnění stadia nemoci na podkladě záchytu mikrometastatického postižení SLN (6).
Podobně jako u vulvárního karcinomu, také i u karcinomu hrdla děložního se hledají cesty na snížení pooperačních komplikací. Snížení radikality na lymfatickém systému je v případě její negativity možné nahrazením systematické lymfadenektomie pouhou detekcí SLN. Připravovaná prospektivní randomizovaná studie SENTIX bude zaměřena na disease-free survival u pacientek s radikální hysterektomií a pouhou detekcí SLN, oproti skupině pacientek s pánevní lymfadenektomií. Největší pooperační morbidita je však spojena s resekcí parametrií, vedoucí především k poruchám mikce a sexuálních funkcí. Jednou z cest je tzv. nervy šetřící chirurgie, která v tomto směru přináší snížení pooperačních komplikací, ale onkologická bezpečnost u vysoce rizikových pacientek není jednoznačně potvrzena (7). Druhou možností je pak neprovádět parametrektomii vůbec. Tento koncept je nyní odbornou veřejností široce diskutován a bude pravděpodobně vhodný pro přesně definovanou low-risk skupinu pacientek s malým nádorem – pod 2 cm, stromální invazí méně než 10 mm a bez přítomné lymfangioinvaze (8, 9).
Vzhledem k mladším věkovým skupinám je aktuální otázkou i zachování fertility. Možností je tzv. radikální trachelektomie, kdy je chirurgicky odstraněn cervix společně s parametrií a děložní tělo je v oblasti istmu suturováno na okraj resekované pochvy. Operace je doplněna pánevní lymfadenektomií. V případě pozitivity SLN, anebo pozitivního resekčního okraje v oblasti istmu je operace konvertována na radikální hysterektomii. Tato operace, která je také spojena s vyšším rizikem recidivy nemoci a která není standardem léčby, je vyhrazena pouze pro vysoce motivované pacientky k těhotenství. Tuto operaci lze provést jak abdominálně, vaginálně, laparoskopicky, tak i roboticky s rozdílnými výsledky dosažených těhotenství. Ve snaze o zvýšení počtu dosažených těhotenství experimentální práce popisují také možnost simplexní trachelektomie (velké konizace) bez resekce parametrií, popřípadě simplexní trachelektomie po předchozí neadjuvantní chemoterapii (10).
Chirurgická léčba recidiv hrdla děložního
Chirurgická léčba recidiv cervikálního karcinomu záleží na předchozí léčbě (primární chirurgie, anebo primární chemoradioterapie) a na lokalizaci recidivy. Centrální pánevní recidiva je na podkladě progrese nemoci v oblasti poševní jizvy po chirurgické léčbě, anebo v oblasti původního nádoru po primární radioterapii. Laterální pánevní recidiva postihuje parietální a viscerální povrchy pánevní stěny. Extrapelvická recidiva nemoci postihuje nejčastěji lymfatické uzliny paraaortální oblasti, játra, plíce a kosti. V italské multicentrické studii, která zahrnovala 327 pacientek s rekurencí cervikálního karcinomu, byla zaznamenána centrální pánevní recidiva v 36,7 %, centrální recidiva v oblasti poševní jizvy 20,5 %, laterální pelvická recidiva v 9,5 %, v oblasti paraaortálních uzlin ve 4,9 % a ostatní distantní metastázy ve 24 %. Obecně platí, že recidivy po primární chirurgické léčbě bez adjuvantní radioterapie jsou řešeny radiační léčbou. V současnosti je však snaha v určitých případech izolovaných recidiv zvážit chirurgickou léčbu. Pacientky po primární radiační léčbě s centrální recidivou mohou být v selektovaných případech kandidátkami na chirurgickou léčbu. V případě malého nádoru (méně než 2 cm) bez postižení přilehlých orgánů je možným řešením radikální hysterektomie, která je však vzhledem k ozářenému terénu zatížena vysokým procentem operačních komplikací. V případě, že jsou postiženy okolní orgány, je metodou volby exenterace pánve, která může být modifikovaná na přední exenteraci v případě postižení močového měchýře, zadní exenteraci v případě postižení rekta, anebo totální exenterace, které dále můžeme dělit, vzhledem ve vztahu k pánevnímu dnu, na I. typ supralevátorový, II. typ infralevátorový a III. typ s vulvektomií (11). Přestože jsou pánevní exenterace extrémně technicky náročné, jejichž nutnou součástí jsou výkony umožňující derivaci moči i stolice, jsou v určitých případech jedinou možnou léčebnou modalitou s kurativním efektem. V multicentrické studii, zahrnující 167 žen, byla exenterace provedena u 27 pacientek pro primární pokročilý nádor, u 34 pacientek pro perzistenci nemoci po primární chemoradioterapii a ve 106 případech pro recidivu nemoci. Kompletní resekce bylo dosaženo v 72,5 % případů, metastatické postižení pánevních uzlin bylo ve 29,3 % případů a postižení pánevní stěny ve 26,3 %. Pětiletý OS pro celou skupinu činil 40,7 % (12). Schmidt publikoval doposud největší soubor pacientek, zahrnující 282 žen s cervikálním karcinomem, které postoupily exenteraci. Exenteraci pánve podstoupilo 70 žen jako primární operaci, 212 pacientek jako sekundární léčbu. Přední exenterace byla provedena v 5 %, zadní ve 2 % a totální v 93 %. Pětiletý OS ve skupině všech pacientek činil 41 a 37 % v 10 letech. Disease-free survival v 5 letech byl 61 %. U 133 pacientek, u kterých byla exenterace provedena s kurativním záměrem, byl OS 64 % v 5. roce a 57 % v 10. roce. U žen, u kterých byla exenterace provedena s paliativním zámětem, činil OS pouze 19 a 18 %. Žádný rozdíl v OS nebyl pozorován u pacientek s pozitivitou pánevních uzlin oproti skupině s negativními uzlinami, zatímco v případě pozitivity paraaortálních uzlin byl OS významně snížen. Závažné komplikace byly zaznamenány u 51 % pacientů (13). Laterální pánevní recidiva je považována za nevhodnou k chirurgickému řešení. Avšak Hockel publikoval v roce 2003 nový chirurgický postup nazvaný LEER (Laterally Extended Ednopelvic Resection) a zahrnuje resekce vnitřního ilického cévního svazku, endoplevickou část musculus obturatorius internus, coccygeus, iliococcygeus a pubococcygeus a v některých případech i resekci pánevní kosti v místě infiltrace tumorem (14). S rozvojem nových zobrazovacích metod, umožňujících přesnější selekci pacientek, s rozvojem nových elektrochirurgických nástrojů a hemostatických přípravků lze očekávat zvýšení počtu pacientek, které budou profitovat z těchto extrémně náročných operací.
CHIRURGICKÁ LÉČBA ZHOUBNÝCH NÁDORŮ TĚLA DĚLOŽNÍHO
Zhoubné nádory těla děložního jsou po karcinomu prsu nejčastější gynekologickou malignitou s incidencí 36,5 na 100 000 žen (UZIS) a chirurgická léčba má své místo u všech stadií. Strategie operační léčby závisí na stadiu onemocnění a na histologickém subtypu nádoru. Většinu pacientek tvoří skupina s endometroidním karcinomem časných stadií, u kterých je metodou volby hysterektomie s oboustrannou adnexetomií. Tradiční laparotomický přístup je s rozvojem miniinvazivních technik nahrazován laparoskopií. Nepotvrdily se původní obavy ohledně onkologické bezpečnosti. Ve studii (GOG) LAP2 bylo randomizováno k laparoskopickému a laparotomickému přístupu 2616 pacientek. Laparoskopie byla spojena s nižší postoperační morbiditou a s vyšší kvalitou života (15).
V následné GOG studii byl pětiletý OS pro obě skupiny identický - 89,8 % (16). Z těchto důvodů je laparoskopický přístup preferován a největší efekt na snížení pooperačních komplikací je u obézních pacientek. V současné době s rozvojem robotické chirurgie jsou tyto obézní ženy vhodné jako kandidátky i pro robotickou chirurgii. U všech miniinvazivních výkonů platí, že je nutné se vyhnout morcelaci dělohy. Pacientky, u kterých velikost dělohy nedovoluje extrakci pochvou bez porušení integrity stěny děložní, jsou kontraindikovány k takovémuto výkonu.
Systematická lymfadenektomie u pacientek se zhoubným nádorem těla děložního je součástí chirurgického stagingu, avšak její role u časných stadií je stále nejasná. Lymfadenektomie zahrnuje jak pánevní, tak paraaortální lymfadenektomii s kraniální hranicí disekce dosahující k renálním žilám. Provedení lymfadenektomie musí být systematické, pouhý sampling má nízkou senzitivitu. Dle recentního společného doporučení ESMO/ESGO/ESTRO je systematická lymfadenektomie indikována u stadia I pouze u high-risk pacientek (invaze nad 50 % myometria, grade 3), u pacientek středního rizika je zvažována pouze ze stagingových důvodů a její eventuální přínos musí zodpovědět nadcházející prospektivní randomizované studie (17).
Detekce sentinelové uzliny u endometriálního karcinomu je také v popředí zájmu onkogynekologů. Výsledky dosavadních studií vzhledem k nejednotnosti aplikačních schémat nedosahují senzitivity a specificity jako u karcinomu vulvy a hrdla děložního. Z možných způsobů aplikace má nejvyšší detekci aplikace do děložního čípku (18, 19, 20).
U pacientek FIGO stadia II s postižením cervixu již není radikální hysterektomie s resekcí parametrií paušálně indikována, ale je přínosná pouze u pacientek s jasným postižením parametrií. U pacientek stadia FIGO III-IV je nutný multimodální přístup se snahou o maximální cytoredukci. Pacientky s jinou než endometroidní histologií (serózní a clear-cell karcinomy) jsou řazeny do skupiny vysokého rizika bez ohledu na hloubku invaze a jsou kandidátkami radikálního chirurgického stagingu (17).
CHIRURGICKÁ LÉČBA KARCINOMU OVARIA
Ovariální karcinom je onemocnění s incidencí 20,1 na 100 000 žen (ÚZIS) (20) a nejvyšší mortalitou mezi gynekologickými nádory. To je dáno záchytem více než 70 % pacientek v pozdních stadiích FIGO III-IV. Na rozdíl od adjuvantní chemoterapie, která je standardní, závisí výsledek samotné chirurgické léčby na mnoha faktorech. Tím základním je, kde je pacientka s ovariální malignitou operována. Z dostupných dat jasně vyplývá, že pacientky operované v onkogynekologických centrech mají větší šanci na adekvátní léčbu dle doporučených národních guidelines, a tím pádem i na lepší celkové přežití než pacientky operované mimo centra (21,22). Cílem vlastní operace je dosažení takzvaného nulového, tj. žádného, nebo pouze mikroskopického nádorového rezidua.
Koncept odstranění maximálně možné nádorové tkáně, tzv. debulking, je široce přijímán teprve necelých 40 let, kdy Griffiths publikoval svoji práci, ve které prokázal korelaci mezi maximálním odstraněním nádorové tkáně a zlepšením přežití u pokročilých stadií onemocnění (23). Otázkou zůstává hodnota tzv. optimální cytoredukce, to znamená velikost ponechaného nádorového rezidua po provedené operaci, aby tato mohla být označena za adekvátně provedenou s pozitivním vlivem na celkové přežití. Původně byla hranice pro optimální cytoredukci stanovena dle velikosti ponechaného nádorového rezidua méně než 2 cm. Tato hranice se však v dalších letech postupně snižovala, až na dnes obecně přijímanou hodnotu „nulového“, tedy pouze mikroskopického postižení (24).
Primární chirurgická léčba časných stadií
U časných stadií ovariálního karcinomu (FIGO I-II) má primární radikální operace význam především stagingový, umožňující rozlišení nízce a vysoce rizikových pacientek s ohledem na případné podání adjuvantní chemoterapie.
Kompletní stagingový výkon je prováděn z dolní střední laparotomie s prodloužením nad pupeční jizvu tak, aby byl sjednán přístup k pečlivé inspekci celé dutiny břišní, tzn. všech peritoneálních povrchů, kliček střevních, povrchu jater a bránice. Další součástí výkonu je provedení hysterektomie s oboustrannou adnexektomií (výjimkou jsou pouze za určitých, přesně definovaných podmínek fertilitu zachovávající operace se snahou o zachování dělohy a eventuálně jednoho ovaria), omentektomie, apendektomie, pánevní a paraaortální lymfadenektomie a biopsie z peritoneálních povrchů.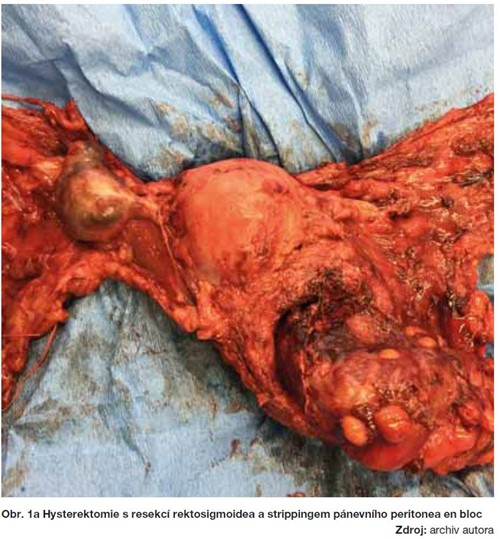
U 20-30 % pacientek dochází při adekvátně provedené stagingové operaci k posunutí do stadia FIGO III, tzv. upstagingu, většinou na podkladě pouze mikroskopického postižení (nejčastější místa mikroskopického postižení jsou paraaortální uzliny, omentum a bránice). Primární stagingový výkon také přináší nižší procento operačních komplikací než je tomu při následné, tzv. restagingové operaci po předchozí neadekvátní operaci (25).
Primární chirurgická léčba u pokročilých stadií
Radikalita primární operační léčby u pokročilých stadií ovariálního karcinomu má zásadní význam na celkové přežití (OS), kdy velikost ponechaného nádorového rezidua jasně koreluje s délkou přežití. Pokročilá stadia jsou heterogenní skupinou s různým stupněm a lokalizací postižení a především u stadií FIGO IIIC a IV se může jednat o rozsáhlé nádorové postižení kliček střevních, mezenteria, bránice, jaterních metastáz, uzlinového postižení nad úrovní renálních cév, až po vzácné mozkové metastázy. Chirurgické řešení těchto postižení vyžaduje specifické operační intervence, které se nepoužívají u žádné jiné gynekologické malignity, a proto vyžadují úzkou mezioborovou spolupráci. 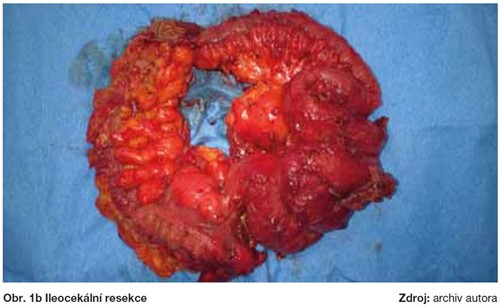 V těchto případech jsou mimo standardní stagingový rozsah prováděny extendované resekční výkony, zahrnující operační výkony na bránici, splenektomii, mnohočetné resekční výkony na kličkách střevních, parciální resekci jater a žaludku, ve výjimečných případech i cytoreduktivní výkony v mediastinu a eventuálně v pleurální dutině (obrázky 1a-1c). Provedení systematické pánevní a paraaortální lymfadenektomie u těchto pokročilých stadií je diskutabilní a měla by být provedena pouze u pacientek s dosaženým mikroskopickým reziduem (24, 26). Proveditelnost a výsledek operační léčby tak závisí především na dvou faktorech: resektabilitě tumoru a celkovém stavu pacientky, umožňujícím jí podstoupit extenzivní chirurgický výkon, při současně únosné pooperační morbiditě a mortalitě.
V těchto případech jsou mimo standardní stagingový rozsah prováděny extendované resekční výkony, zahrnující operační výkony na bránici, splenektomii, mnohočetné resekční výkony na kličkách střevních, parciální resekci jater a žaludku, ve výjimečných případech i cytoreduktivní výkony v mediastinu a eventuálně v pleurální dutině (obrázky 1a-1c). Provedení systematické pánevní a paraaortální lymfadenektomie u těchto pokročilých stadií je diskutabilní a měla by být provedena pouze u pacientek s dosaženým mikroskopickým reziduem (24, 26). Proveditelnost a výsledek operační léčby tak závisí především na dvou faktorech: resektabilitě tumoru a celkovém stavu pacientky, umožňujícím jí podstoupit extenzivní chirurgický výkon, při současně únosné pooperační morbiditě a mortalitě. 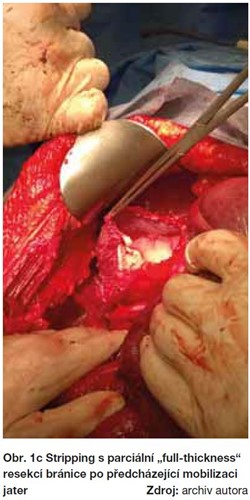 Proto je v popředí zájmu eventuální nahrazení primární debulkingové operace (PDS) neoadjuvantní chemoterapií (NACT) se záměrem zmenšení nádorových hmot a poté, s odstupem několika cyklů chemoterapie, provedení vlastní cytoreduktivní operace, tzv. Interval Debulking Surgery (IDS). Prozatím však nejsou jasné jednoznačné charakteristiky nádoru, umožňující rozlišení vhodných kandidátek pro NACT-IDS oproti PDS.
Proto je v popředí zájmu eventuální nahrazení primární debulkingové operace (PDS) neoadjuvantní chemoterapií (NACT) se záměrem zmenšení nádorových hmot a poté, s odstupem několika cyklů chemoterapie, provedení vlastní cytoreduktivní operace, tzv. Interval Debulking Surgery (IDS). Prozatím však nejsou jasné jednoznačné charakteristiky nádoru, umožňující rozlišení vhodných kandidátek pro NACT-IDS oproti PDS.
V retrospektivní GOG (Gynecologic Oncology Group) studii, zahrnující 1895 pacientek stadia FIGO IIIC, byly vyhodnoceny jako rizikové faktory pro recidivu onemocnění: vyšší věk, mucinózní a clear-cell typ nádoru, performance status a velikost nádorového rezidua (27). Vzhledem k nemožnosti ovlivnit tyto negativní prognostické faktory, vyplývající z biologické charakteristiky nádoru a celkového stavu pacientky, je jediným ovlivnitelným faktorem se vztahem na zlepšení celkového přežití adekvátnost provedené operace, tedy rozsah ponechaného nádorového rezidua.
Je nutné si uvědomit, že v této skupině pacientek nelze dosáhnout optimální cytoredukce ve 100 %. Nejlepších výsledků je dosaženo ve studiích z jednotlivých center na rozdíl od multicentrických studií.
V retrospektivní studii z Mayo Clinic bylo analyzováno 194 pacientek a u 131 pacientek (67,5 %) bylo dosaženo optimální cytoredukce. V této studii byla definice pro optimální cytoredukci: léze menší než 1 cm, ne nyní obecně přijímané pouze mikroskopické reziduum. V podskupině 144 pacientek s karcinomatózou bylo pětileté přežití u pacientek s optimálním v porovnání s větším ponechaným reziduem: 46 vs. 17 % (28).
Obdobně v retrospektivní práci z Memorial Sloan-Kettering Cancer Center zahrnující 316 pacientek, z nichž 90 % podstoupilo primární operační léčbu, bylo dosaženo mikroskopického rezidua ve 24 % a rezidua pod 1 cm ve 47 %. S velikostí nádorového rezidua tak koreluje i celkové přežití, které u skupiny pouze s mikroskopickým reziduem bylo 78 měsíců, ve skupině do 1 cm 50 měsíců a u pacientek s reziduem nad 1 cm 36 měsíců (29). Zásadní vliv optimální cytoredukce, tzn. dosažení pouze mikroskopického nádorového rezidua na OS, bylo potvrzeno také v analýze 3 prospektivních multicentrických studií AGO-OVAR (OVAR-3/-5/-7).
Z celkového počtu 3126 pacientek bylo dosaženo optimální cytoredukce u 33,5 % pacientek. V této skupině byl OS 99,1 měsíců v porovnání s pacientkami s velikostí nádorového rezidua 0,1-1cm a nad 1 cm, kde OS činil 36,2 a 29,6 měsíců (24).
Naproti tomu prospektivní multicentrická studie EORTC-NCIC, zaměřená na porovnání PDS a NACT-IDS a zahrnující 632 pacientek z 59 center, prokázala lepší výsledky pro dosažení nádorového rezidua méně než 1 cm u skupiny žen po NACT-IDS (80,6 %), oproti skupině žen s PDS (41,6 %), a to i při nižší pooperační morbiditě. Je ale nutné zdůraznit, že ve skupině žen s optimální cytoredukcí (pouze mikroskopické reziduum) po NACT-IDS byl OS pouze 38 měsíců a ve skupině žen s PDS také pouze 45 měsíců (30), což odpovídá hodnotám pro skupinu žen se suboptimálním debulkingem.
Nejhorší prognózu mají samozřejmě pacientky stadia FIGO IV, u nichž je dosažení optimální cytoredukce vzhledem k nádorovému postižení mimo dutinu břišní velmi obtížné. U této heterogenní skupiny pacientek závisí úspěšnost operační léčby především na místě distantních metastáz. GOG studie zaměřená pouze na pacientky stadia FIGO IV analyzovala výsledky léčby u této prognosticky nepříznivé skupiny pacientek zařazených v předešlých studií (GOG protokol 111, 132, 152 a 162). Z celkem 360 pacientek (48 % s postižením pleury) bylo dosaženo mikroskopického rezidua pouze u 8 % pacientek. U této skupiny pacientek činilo OS 64 měsíců, na rozdíl od skupiny pacientek s jakýmkoliv jiným reziduem (0,1-5,0 cm), kde OS bylo 28 měsíců (31).
Obdobných výsledků bylo dosaženo v analýze 3 prospektivních multicentrických studií AGO-OVAR (OVAR-3/-5/-7). Mikroskopického rezidua bylo dosaženo pouze u 12,3 % pacientek z celkového počtu 573 pacientek. U této skupiny pacientek bylo dosaženo OS v délce 54,6 měsíců, na rozdíl od 23,9 u pacientek s makroskopickým reziduem (32).
Chirurgická léčba recidiv ovariálního karcinomu
Také u recidiv ovariálního karcinomu má své místo chirurgická léčba, která vychází z principu dosažení nulového rezidua. Zásadní je však správná selekce pacientek. V retrospektivní studii DESKTOP, která zahrnovala 267 pacientek, bylo dosažení nulového rezidua spojeno se signifikantně delším OS v porovnání s pacientkami s ponechaným jakýmkoliv reziduem (45,2 vs. 19,7 měsíců). Faktory spojené s předpokladem kompletní resekce byly: performance status (PS 0), stadium nemoci při primární operaci (FIGO I/II vs. III/IV), ponechané nádorové reziduum při primární operaci a nepřítomnost ascitu. Při kombinaci PS, časného stadia nemoci bez ponechání nádorového rezidua při primární operaci a nepřítomnosti ascitu lze predikovat dosažení kompletní resekce u 79 % pacientek. Samostatnou skupinu tvoří pacientky s karcinomatózou peritonea. V této studii se také nepotvrdil žádný rozdíl v přežití u skupiny pacientek s dosaženým tzv. optimálním debulkingem (reziduum 1-10 mm) a reziduem nad 1 cm (32). V následné analýze podskupiny pacientek s peritoneální karcinomatózou ze studie DESKTOP bylo dosaženo nulového rezidua pouze u 26 % pacientek v porovnání s 74 % pacientek bez karcinomatózy. Nicméně, při dosažení nulového rezidua u této prognosticky nepříznivé skupiny činilo 2leté přežití 77 %, shodně s 2letým přežitím jako u pacientek bez karcinomatózy (33). Faktory definované ve studii DESKTOP a spojené s kompletní resekcí recidivy ovariálního nádoru byly následně validovány a potvrzeny v prospektivní studii DESKTOP II (34). Z celkového počtu 129 pacientek s primární recidivou platina senzitivního nádoru bylo kompletní resekce dosaženo u 76 % pacientek. Další prediktivní model pro dosažení kompletní resekce recidivy nemoci byl publikován v mezinárodní multicentrické studii zahrnující 1075 pacientek. Skórovací systém zahrnoval 6 faktorů: FIGO stadium, nádorové reziduum po primární operaci, progression-free interval, performance status, Ca 125 a přítomnost ascitu v době recidivy.
U pacientek s nízkým skóre bylo dosaženo kompletní cytoredukce v 53,4 % případů oproti 20,1 % u pacientek s vysokým skóre (35). Nové poznatky do této kontroverzní problematiky mohou přinést výsledky probíhající radomizované studie DESKTOP III, srovnávající cytoreduktivní chirurgickou léčbu následovanou chemoterapií na podkladě platiny versus samotnou chemoterapii u 408 platina senzitivních pacientek s prvním relapsem nemoci.
LITERATURA
- Van der ZEEAG, OONK MN, De HULLU JA, ANSINK AC. et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol, 2008; 20(26): 6: p. 884-889.
- LEVEBACK CR, ALI S, COLEMAN RL. et al. Lymphatic mapping and sentinel lymph node biopsy in women with squamous cell carcinoma of the vulva: a gynecologic oncology group study. J Clin Oncol, 2012; 1: p. 3786-3791.
- OONK MH, van HEMEL BM, HOLLEMA H. et al. Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: results from GROINSS-V, a multicentre observational study. Lancet Oncol, 2010; 11: p. 646-652.
- GROOTENHUIS NC, van der ZEE AGJ, van DOORN HC. et al. Sentinel nodes in vulvar cancer: Long-term follow-up of the GROningen INternational study on Sentinel nodes in vulvar cancer (GROINSS-V) II. Gynecol Oncol, 2016; 140: p. 8-14.
- KIM HS, SARDI JE, KATSUMATA N. et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis. Eur J. Surg Oncol, 2013; 39: p. 115-1124.
- CIBULA D, ABU-RUSTUM NR, DUSEK L. et al. Prognostic significance of low volume sentinel lymph node disease in early-stage cervical cancer. Gynecol Oncol, 2012; 124: p. 496-501.
- BASARAN D, DUSEK L, MAJEK O. et al. Oncological outcomes of nerve-sparing radical hysterectomy for cervical cancer: a systematic review. Ann Sur Oncol, 2015; 22: p. 3033-3040.
- RAMIREZ PT, PAREJA R, RENDGDÔN J. et al. Management of low-risk early-stage cervical cancer: should conization, simple trachelectomy, or simple hysterectomy replace radical surgery as the new standard of care? Gynecol Oncol, 2014;132: p. 254-259.
- READE CJ, EIRIKSSON LR, COVENS A. Surgery for early stage cervical cancer: how radical should it be? Gynecol Oncol, 2013; 131: p. 222-2230.
- ROBOVA H, ROB L, HALASKA MJ. et al. Review of neoadjuvant chemotherapy and trachelectomy: Which cervical cancer patiens would be suitable for neoadjuvant chemotherapy folowed by fertility-sparing Surgery? Current Oncol Reports, 2015; 17: p. 446-500.
- MAGRINA JF, STANHOPE CR, WEAVER AL. Pelvic exenterations: supralevator, infralevator, and with vulvectomy. Gynecol Oncol, 1997; 64: p. 130-135.
- CHIANTERA V, ROSS, M, De IACO P. et al. Survival After Curative Pelvic Exenteration for Primary or Recurrent Cervical Cancer: A Retrospective Multicentric Study of 167 Patients. Int J Gynec Cancer, 2014; 24: p. 916-922.
- SCHMIDT A, IMESCH P, FINK D, EGGER H. Indications and long-term clinical outcomes in 282 patients with pelvic exenteration for advanced or recurrent cervical cancer. Gynecol Oncol, 2012; 125: p. 604-609.
- HOCKEL M. Laterally extended endopelvic resection. Novel surgical tretment of locally recurrent cervical carcinoma involving the pelvic side wall. Gynecol Oncol, 2003; 91: p. 369-377.
- WALKER JL, PIEDMONTE MR, SPIRTOS NM. et al. Laparoscopic compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol, 2009; 10(32): p. 5331-5336.
- WALKER KL, PIEDMONTE MR, SPIRTOS NM. et al. Recurrence and survival after random assignment to laparoscopy versus laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group LAP2 Study. J Clin Oncol, 2012; 1(30): p. 695-700.
- COLOMBO N, CREUTZBERG C, AMANT F. et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: diagnosis, treatment and follow-up. Ann Oncology, 2015; 2016; 27: p. 16-41.
- BALLESTER M, DUBERNARD G, LECURU F. at al. Detection rate and diagnostic accuracy of sentinel-node biopsy in early stage endometrial cancer: a prospective multicentre study (SENTI-ENDO). Lancet, 2011; 12: p. 469-476.
- CORMIER B, ROZENHOLC AT, GOTLIEB W. et al. Sentinel lymph node procedure in endometrial cancer: A systematic review and proposal for standardization of future research. Gynecol Oncol, 2015; 138: p. 478-785.
- http://www.uzis.cz/cz/dps/index.html
- BOIS DA, ROCHON J, LAMPARTER C. and for AGO Organ commission PFisterer J. Pattern of care and impact of participation in clinical studies on the outcome in ovarian cancer. Int J Gynec Cancer, 2005; 15: p. 183-191.
- GOFF BA, MATTHEWS BJ, LARSON EH. et al. Predictors of comprehensive surgical treatment in patients with ovarian cancer. Cancer, 2007; 109: p. 2031-2042.
- GRIFFITHS CT. Surgical resection of tumor bulk in the primary treatment of ovarian carcinoma. Natl Cancer Inst Monogr, 1975; 42: p. 101-104.
- BOIS DA, REUSS A, PUJADE-LAURAINE E. et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: A combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials. Cancer, 2009; 15: p. 1234-1244.
- SCHUELER JA, TRIMBOS JB, HERMANS J, FLEUREN GJ. The yield of surgical staging in presumed early stage ovarian cancer; benefits or doubts? Int J Gynecol Cancer, 1998; 8: p. 95-102.
- BENEDETTI-PANICI P, MAGGIONI A, HACKER N. et al. Systematic aortic and pelvic lymphadenectomy versus resection of bulky nodes only in optimally debulked advanced ovarian cancer: A randomized clinical trial. J Natl Cancer Inst, 2005; 97: p. 560-566.
- WINTER WE, MAXWELL L, TIAN CH. et al. Prognostic factors for stage III epithelial ovarian cancer: A Gynecology Oncology Group Study. J Clin Oncol, 2007; 25: p. 3621-3627.
- ALETTI GA, DOWDY SC, GOSTOUT BS. et al. Aggresive surgical effort and improved survival in advancede-stage ovarian cancer. Obstet Gynecol, 2006; 107: p. 77-85.
- CHI DS, MUSA F, DAO F. et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs neoadjuvant chemotherapy (NACT). Gynecol Oncol, 2012; 124: p. 10-14.
- VERGOTE I, TROPÉ CG, AMANT F. et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Eng J Med, 2010; 363: p. 943-953.
- WINTER WE, MAXWELL GL, TIAN CH. et al. Tumor residua lafter surgical cytoreduction in prediction of clinical outcome in stage IV epithelial Ovarian Cancer: A Gynecologic Oncology Group Study. J Clin Oncol, 2008; 26: p. 83-89.
- HARTER P, BOIS AD, HAHMANN M. et al. Surgery in Recurrent Ovarian Cancer: The Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR Trial. Ann Surgic Oncol, 2006; 13(12): p. 1702-1710.
- HARTER P, HAHMANN M., LUECK HJ. Surgery for Recurrent Ovarian Cancer: Role of Peritoneal Carcinomatosis: Exploratory Analysis of the DESKTOP I Trial About Risk Factors, Surgical Implications, and Prognostic Value of Peritoneal Carcinomatosis. Ann Surgic Oncol, 2009; 16: p. 1324-1330.
- HARTER P, SEHOULI J, REUSS A. et al. Prospective Validation Study of a Predictive Score for Operability of Recurrent Ovarian Cancer: The Multicenter Intergroup Study DESKTOP II. A Project of the AGO Commission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO. Int J Gynec Cancer, 2011; 2: p. 289-295.
- ZANG RY, HARTER P, CHI DS. et al. Predictors of survival in patients with recurrent ovarian cancer undergoing secondary cytoreductive surgery based on the pooled analysis of an international collaborative cohort. British J Cancer, 2011; 105: p. 890-896.