Přelomová studie ADAURA - osimertinib v adjuvantní léčbě EGFR mutovaného NSCLC
01/2022
MUDr. Marie Drösslerová
Pneumologická klinika 1. LF UK a Fakultní Thomayerovy nemocnice, Praha
SOUHRN
Ani radikální chirurgická léčba časného stadia nemalobuněčného plicního karcinomu (non-small cell lung cancer, NSCLC) nedává jistotu vyléčení. Adjuvantní chemoterapie zlepšuje absolutní pětileté přežití pouze o cca 5 %. Řadu let nedošlo v adjuvanci k zásadní inovaci. Studie ADAURA přináší průlom. Došlo dokonce k jejímu předčasnému odslepení. Důvodem jsou impozantní výsledky osimertinibu v adjuvantním podání u pacientů s NSCLC s mutací receptoru epidermálního růstového faktoru (epidermal growth factor receptor, EGFR), stadia IB-IIIA. A právě přelomové studii ADAURA je článek níže věnován.
Klíčová slova
NSCLC (nemalobuněčný plicní karcinom), stadium IB-IIIA, EGFR mutace, osimertinib, adjuvantní léčba
SUMMARY
Even radical surgical treatment of early stage non-small cell lung cancer (NSCLC) does not provide 100% chance to be definitely cured. Adjuvant chemotherapy increases the 5-year survival rates by around 5%. There have been no advances in adjuvant treatment for a long time. ADAURA is a breakthrough trial. The trial was unblinded early after overwhelming efficacy in the adjuvant treatment of patients with stage IB-IIIA EGFR (epidermal growth factor receptor)-mutated NSCLC. This article describes ground-breaking ADAURA trial.
Key words
NSCLC (non-small cell lung cancer), stage IB-IIIA, EGFR mutation, osimertinib, adjuvant treatment
ÚVOD
Nemalobuněčný plicní karcinom (non-small cell lung cancer, NSCLC) tvoří zhruba 80 % všech plicních karcinomů. Léčba se odvíjí od přesného určení rozsahu onemocnění (klinického stadia podle zásad TNM klasifikace), morfologické diagnózy a výkonnostního stavu pacienta. Ani záchyt NSCLC v časném stadiu nedává jistotu vyléčení. V případě stadia I se pětileté přežití pohybuje v rozmezí 70-90 %, u stadia IIIA okolo 35-40 %. Značná část recidiv NSCLC po provedené resekci zahrnuje vzdálené metastázy.
Ve stadiu I a II je diagnostikováno zhruba 20-25 % nemocných s NSCLC. Pokud jsou dotyční v dobrém výkonnostním stavu, je základním léčebným přístupem radikální resekce tumoru s kurativním záměrem. Za radikální výkon je považována minimálně anatomická lobektomie s lymfadenektomií plicního hilu a mediastina.
Přibližně u 25 % pacientů s NSCLC je diagnóza stanovena ve stadiu III. Radikální resekci lze provést ve stadiu IIIA, při rozhodování hraje stěžejní roli rozsah postižení regionálních lymfatických uzlin.
Adjuvantní chemoterapie je po resekci indikována u stadií II, IIIA a vybraných skupin pacientů stadia IB. U stadia IB je nutno zvažovat úzký index terapeutické účinnosti, toxicity a rizikové faktory chemoterapie. U stadia IIIA připadá v úvahu neoadjuvantní chemoterapie, případně radikální chemoradioterapie. Z metaanalýz velkých studií fáze 3 vyplývá, že při podání adjuvantní chemoterapie dochází k absolutnímu zlepšení pětiletého přežití o zhruba 5 %.
Z tohoto důvodu jsou hledány nové možnosti adjuvantní a neoadjuvantní léčby.
Osimertinib patří mezi 3. generaci tyrosinkinázových inhibitorů cílících na receptor pro epidermální růstový faktor (epidermal growth factor receptor, EGFR). Inhibuje aktivační EGFR mutace (delece na exonu 19, substituční mutace L858R v exonu 21), předchází vzniku EGFR mutace T790M, která je odpovědná za rezistenci a má minimální vliv na nemutovanou formu EGFR. Rovněž přechází přes nepoškozenou hematoencefalickou bariéru a má dobrou intrakraniální aktivitu. Osimertinib je v monoterapii indikován v první linii léčby dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC s aktivačními mutacemi EGFR, dále k léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC s přítomnou mutací EGFR T790M. Navíc j e nově v monoterapii osimertinib indikován k adjuvantní léčbě po úplné resekci nádoru u dospělých pacientů s NSCLC ve stadiu IB—IIIA, jejichž nádory mají deleci exonu 19 receptoru EGFR nebo substituční mutaci exonu 21 (L858R). Účinnost osimertinibu v adjuvantním podání byla prokázána ve studii ADAURA, o které tento článek pojednává.
STUDIE ADAURA (NCT02511106)
Úvod ke studii
ADAURA je randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická, mezinárodní studie fáze III. Cílem je zhodnocení účinnosti a bezpečnosti osimertinibu oproti placebu v adjuvantní léčbě pacientů po úplné resekci EGFR pozitivního NSCLC stadia IB—IIIA.
Pacienti
Zařazení pacienti byli po úplné resekci primárně neskvamózního NSCLC, který podle patologické klasifikace odpovídal stadiu IB-IIIA (podle 7. edice klasifikace American Joint Committee on
Cancer [AJCC]) a zároveň u něj byla prokázána EGFR mutace - delece na exonu 19 nebo substituční mutace L858R (samotná nebo v kombinaci s jinými EGFR mutacemi). Standardní adjuvantní chemoterapie byla po resekci NSCLC povolená, ne však vyžadovaná a proběhla ještě před randomizací. Rozhodnutí o jejím podání bylo učiněno ošetřujícím lékařem a pacientem před zařazením do studie.
Další podmínkou účasti ve studii byl věk minimálně 18 let a dobrý výkonnostní stav (performance status, PS) podle World Health Organization (WHO) odpovídající 0 nebo 1. Pacienti nesměli před ani po operaci absolvovat radioterapii.
Uspořádání studie a léčba
Po resekci NSCLC a případné adjuvantní chemoterapii následoval screening a randomizace.
Randomizaci podstoupilo v poměru 1 : 1 celkem 682 pacientů. Mezi stratifikační faktory patřilo stadium NSCLC (IB/II/IIIA), typ EGFR mutace (delece na exonu 19 / substituční mutace L858R) a etnická příslušnost (asijská/neasijská). V prvním rameni 339 pacientů užívalo osimertinib (dávka 80 mg perorálně jednou denně), ve druhém kontrolním rameni 343 pacientů užívalo placebo. Léčbu bylo možno podávat maximálně tři roky. K dřívějšímu ukončení došlo při potvrzené recidivě onemocnění nebo při splnění některého kritéria pro ukončení léčby.
Cíle studie
Primárním cílem studie bylo stanovení přežití bez nemoci (disease-free survival, DFS) hodnocené investigátorem u pacientů s NSCLC stadia II a IIIA. Přežití bez nemoci bylo definováno jako čas od randomizace do recidivy onemocnění (potvrzené zobrazovacími metodami nebo biopsií) nebo do smrti z jakékoli příčiny.
Mezi sekundární cíle patřilo především zhodnocení DFS v celkové populaci ve studii, tj. u pacientů s NSCLC stadia IB-IIIA, dále celkového přežití (overall survival, OS), kvality života a bezpečnosti.
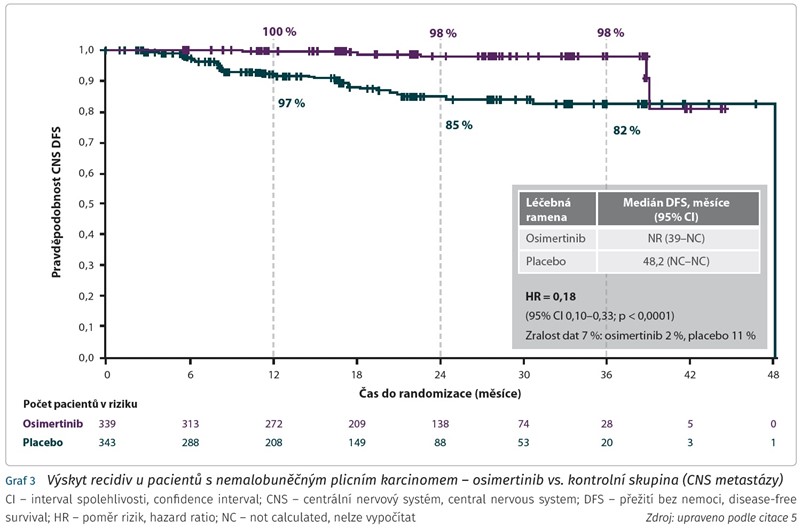
Předem specifikovaným výzkumným cílem studie bylo zjistit, ve kterém orgánu došlo k recidivě onemocnění (včetně centrálního nervového systému [CNS]) a určení času do recidivy nemoci v CNS nebo do smrti.
Výsledky - pacienti a léčba
Mezi listopadem 2015 a únorem 2019 došlo k randomizaci 682 pacientů (339 do ramene s osimertinibem, 343 do kontrolního ramene s placebem). V čase odslepení byl nábor do studie dokončený a minimální doba sledování pacientů činila jeden rok.
Vstupní charakteristiky byly mezi oběma rameny vyrovnané. Věkový medián byl 64 let v rameni s osimertinibem, 62 let v kontrolním rameni. Výrazně převažovaly ženy, nekuřáci, Asiati a WHO PS 0. Zařazení měli v drtivé většině diagnostikovaný adenokarcinom, pro který podstoupili nejčastěji lobektomii. V obou ramenech byla jednotlivá stadia NSCLC (IB, II, IIIA) zastoupena zhruba po třetině a převažovala delece na exonu 19 (55 %) nad substituční mutací L858R (45 %). V každém rameni 60 % pacientů obdrželo adjuvantní chemoterapii na bázi platiny.
V době hodnocení byl u všech zařazených medián trvání léčby 22,5 měsíce na osimertinibu, 18,7 měsíce na placebu, v přiděleném studijním režimu pokračovalo 205 pacientů na osimertinibu a 136 na placebu. K ukončení léčby došlo u 92 pacientů na osimertinibu a 174 pacientů na placebu. U 49 pacientů na osimertinibu byla nutná redukce dávky.
Výsledky - účinnost
Adjuvantní léčba osimertinibem u pacientů s radikálně resekovaným, EGFR mutovaným NSCLC (EGFR mutace - delece na exonu 19 / substituční mutace L858R) statisticky významně snížila riziko recidivy onemocnění nebo úmrtí oproti placebu. Benefit osimertinibu v parametru DFS byl zaznamenán napříč všemi předdefinovanými podskupinami (bez ohledu na stadium onemocnění, anamnézu kouření, etnickou příslušnost, pohlaví, věk, typ EGFR mutace) a nezávisle na tom, zda byla, nebo nebyla podána předchozí adjuvantní chemoterapie.
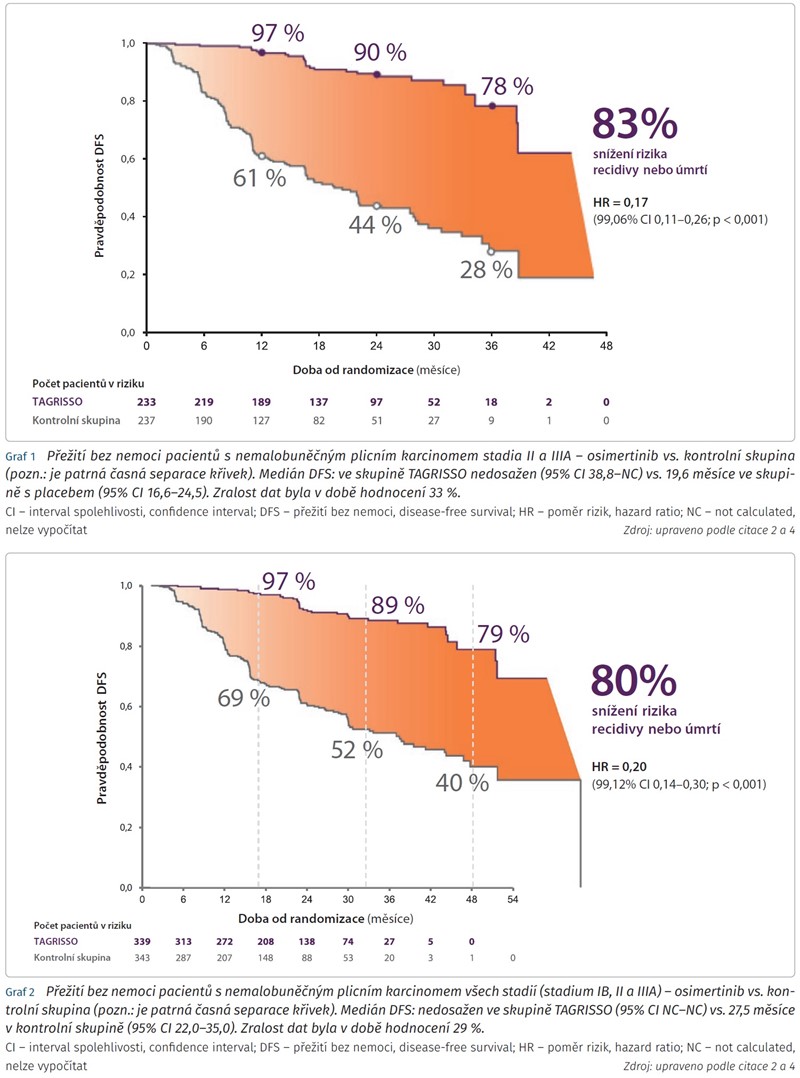
Primární cíl studie byl zaměřen na pacienty s radikálně resekovaným EGFR mutovaným NSCLC stadia II a IIIA, celkem šlo o 470 osob. U 156 z nich došlo k recidivě NSCLC nebo smrti, z toho bylo 130 osob na placebu a jen 26 na osimertinibu. Medián sledování pro DFS byl v době hodnocení 22,1 měsíce u osimertinibu, 14,9 měsíce u placeba. Ve 24 měsících bylo naživu a bez recidivy nemoci 90 % pacientů na osimertinibu a 44 % na placebu. Při adjuvantním podávání osimertinibu tedy došlo k 83% snížení rizika recidivy nebo úmrtí ve srovnání s placebem u pacientů stadia II a IIIA (poměr rizik [hazard ratio, HR] 0,17; 99,06% interval spolehlivosti [confidence interval, CI] 0,11-0,26; p < 0,001) (graf 1). Mediánu DFS nebylo v rameni s osimertinibem dosaženo, u placeba činil 19,6 měsíce.
Jak již bylo zmíněno, adjuvantně podávaný osimertinib ukázal přesvědčivý přínos v parametru DFS napříč všemi stadii NSCLC (IB, II a IIIA). V této populaci adjuvantní osimertinib snížil riziko recidivy nebo úmrtí o 80 % oproti placebu (HR 0,20; 99,12% CI 0,14-0,30; p < 0,001) (graf 2). Míra DFS po 2 letech byla pro rameno osimertinibu obdobně vysoká nezávisle na stadiu onemocnění v době stanovení diagnózy (88 % pro stadia IB a IIIA; 91 % pro stadium II).
Mediánu DFS nebylo rovněž v rameni s osimertinibem dosaženo, v kontrolní skupině dosáhl 27,5 měsíce.
Adjuvantně podávaný osimertinib významně snížil riziko vzniku lokoregionálních a především vzdálených recidiv, včetně recidiv v CNS. V CNS snížil osimertinib riziko recidivy nebo úmrtí o celých 82 % (HR 0,18; 95% CI 0,10-0,33) (graf 3).
Výsledky - bezpečnost
Bezpečnostní profil osimertinibu v adjuvantním podání byl podobný jeho známému bezpečnostnímu profilu v léčbě lokálně pokročilého nebo metastazujícího EGFR mutovaného NSCLC. Nežádoucí účinek byl hlášen u 98 % pacientů léčených osimertinibem, u 89 % pacientů s podáváním placeba, přičemž většina nežádoucích účinků byla nízkého nebo středního stupně. Při léčbě osimertinibem nejčastěji vznikl průjem (46 % pacientů), dále paronychia (25 %) a suchá kůže (23 %). V době analýzy bezpečnosti nebylo ve skupině s osimertinibem hlášeno žádné úmrtí v důsledku nežádoucího účinku, v kontrolní skupině došlo k jednomu úmrtí.
ZÁVĚR
Osimertinib je lékem první volby u EGFR mutovaného pokročilého NSCLC. Významně prodlužuje přežití, má velmi dobrou intrakraniální aktivitu a příznivý bezpečnostní profil. Svoji účinnost a bezpečnost prokázal i v adjuvantním podání. Málokdy se u studií NSCLC stane, že jsou výsledky natolik impozantní, aby došlo k předčasnému odslepení a následnému schválení tak, jako je tomu u studie ADAURA. Osimertinib je v adjuvanci schválen Food and Drug Administration (FDA) i European Medicines Agency (EMA), ale v České republice není zatím hrazen z prostředků veřejného zdravotního pojištění. Výsledky studie ADAURA jsou nicméně natolik přesvědčivé, že bychom měli u resekovaného NSCLC stadia IB-IIIA vyšetřovat EGFR mutace a při jejich průkazu (delece na exonu 19 / substituční mutace L858R) žádat o individuální úhradu cestou paragrafu 16. Doporučená dávka osimertinibu pro adjuvantní léčbu je 80 mg jedenkrát denně, nalačno nebo po jídle, po dobu tří let. Uvedenou léčbou snížíme i riziko vzniku vzdálených metastáz, zejména metastáz do CNS. Takto naši pacienti s resekovaným EGFR mutovaným NSCLC dostanou šanci na výrazně delší přežití, než je tomu při standardní adjuvantní chemoterapii.
LITERATURA
- Indini A, Rijavec E, Bareggi C, Grossi F. Novel treatment strategies for early-stage lung cancer: the oncologist’s perspective. J Thorac Dis 2020;12:3390-3398.
- Wu YL, Tsuboi M, He J, et al.; ADAURA Investigators. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med 2020;383:1711-1723.
- European Medicines Agency. Tagrisso: Summary of product characteristics, 2021 [online]. Dostupné na: https://www.ema.europa.eu/en/ documents/product-information/tagrisso-epar-product-information_cs.pdf
- AstraZeneca Pharmaceuticals. TAGRISSO" (osimertinib). Summary of product characteristics, 2021 [online]. Dostupné na: https://www.tagrisso-global.com/moa.html
- Tsuboi M, Wu Y, He J, et al. LBA1 - osimertinib adjuvant therapy in patients (pts) with resected EGFR mutated (EGFRm) NSCLC (ADAURA): Central nervous system (CNS) disease recurrence. Ann Oncol 2020;31(Suppl 4):S1142-S1215.