Dlouhodobá léčebná odpověď na sekvenční léčbu tyrosinkinázovými inhibitory u pacientky s EGFR+ adenokarcinomem – kazuistika
01/2021
MUDr. Bc. Petr Zůna
Klinika pneumologie 3. LF UK a Nemocnice Na Bulovce, Praha
SOUHRN
Bronchogenní karcinom se řadí mezi nádory s velmi špatnou prognózou. Pacienti s plicním karcinomem a prokázanou mutací v genu pro receptor epidermálního růstového faktoru (EGFR) jsou indikováni k cílené terapii tyrosinkinázovými inhibitory vzhledem k celkově dobré toleranci léčby a statisticky významnému delšímu přežití oproti chemoterapii. Naše kazuistika prezentuje dlouhodobé přežití 78leté pacientky s nemalobuněčným karcinomem plic a mutací genu EGFR léčené cílenou léčbou.
Klíčová slova
nemalobuněčný plicní karcinom, EGFR
SUMMARY
Lung cancer is one of the tumours with very bad prognosis. Patients with epidermal growth factor receptor (EGFR) positive lung cancer are treated with tyrosine kinase inhibitors with good treatment tolerance and statistically significant improved survival outcome. Case report presents long survival of the 78 years old patient with EGFR positive non-small cell lung cancer on targeted therapy.
Key words
non-small cell lung cancer, EGFR
ÚVOD
Bronchogenní karcinom patří mezi onkologická onemocnění s velmi špatnou prognózou. Časná stadia onemocnění bývají zpravidla asymptomatická. Tři čtvrtiny pacientů přicházejí již s lokálně pokročilým nebo inoperabilním metastazujícím karcinomem.1 Základem léčby těchto pacientů byla až do nedávné doby systémová chemoterapie v kombinaci s radioterapií. Objev řídicích mutací genů pro tyrosinkinázové receptory a možnost jejich blokády přinesly pro vybranou skupinu pacientů výrazný benefit v celkovém přežití a kvalitě života. Širšímu využití tyrosinkinázových inhibitorů přispělo zavedení reflexního testování mutací genů EGFR (receptor epidermálního růstového faktoru [epidermal growth factor receptor]), ALK (anaplastická lymfomová kináza [anaplastic lymphoma kinase]) a ROS-1 (proto-oncogene tyrosine-protein kinase 1) u plicních adenokarcinomů. Testování vzácnějších mutací jako RET, BRAF nebo NTRK1 se zatím vzhledem k absenci úhrady cílené terapie rutinně neprovádí.
Gen EGFR se řadí do skupiny genů kódujících transmembránové receptory rodiny Erb, jejíž součástí je EGFR. Regulovanou aktivací receptoru se spouští intracelulární signalizace směrem k buněčné proliferaci a růstu. Mutace v genu pro EGFR však vedou k nekontrolované aktivaci tohoto receptoru a tím také k deregulaci proliferace buněk a vzniku neoplazie.
Mezi nejčastější aktivační mutace patří delece v exonu 19 a bodová mutace L858R v exonu 21, které jsou dohromady odpovědné za 85-90 % všech mutací EGFR.2 Pacienti s přítomnou mutací EGFR jsou indikováni k terapii s tyrosinkinázovými inhibitory 1., 2. nebo případně 3. generace (gefitinib, erlotinib, afatinib, dacomitinib, osimertinib).
Asi dvě třetiny pacientů léčených inhibitory 1. a 2. generace po určité době vyvinou k léčbě rezistentní mutaci T790M, která je podkladem progrese tumoru. Tito pacienti pak výrazně profitují z terapie inhibitorem 3. generace - osimertinibem v druhé linii léčby.
POPIS PŘÍPADU
Naše pacientka je 78letá polymorbidní běloška, bývalá příležitostná kuřačka (méně než dva balíčkoroky) s chronickou obstrukční plicní nemocí stadia IA nevyhraněného fenotypu, dlouhodobě pouze s úlevovou medikací, kterou v podstatě neužívá. Pacientka je těžká kardiačka s chronickým srdečním selháváním v terénu pokročilé ischemické choroby srdeční a paroxysmální fibrilace síní na zavedené antikoagulační terapii kumariny. Dále má v anamnéze diabetes mellitus 2. typu, s perorální antidiabetickou terapií, hyperurikemii a dyslipidemii s terapií, osteoporózu a chronickou žilní insuficienci. Všechny její interní komorbidity jsou dlouhodobě kompenzované. Alergie neguje. Povoláním byla dříve přadlena v bavlnářských závodech, nyní je již ve starobním důchodu a pobývá v domě s pečovatelskou službou. Syn pravidelně dochází a doprovází pacientku na ambulantní kontroly.
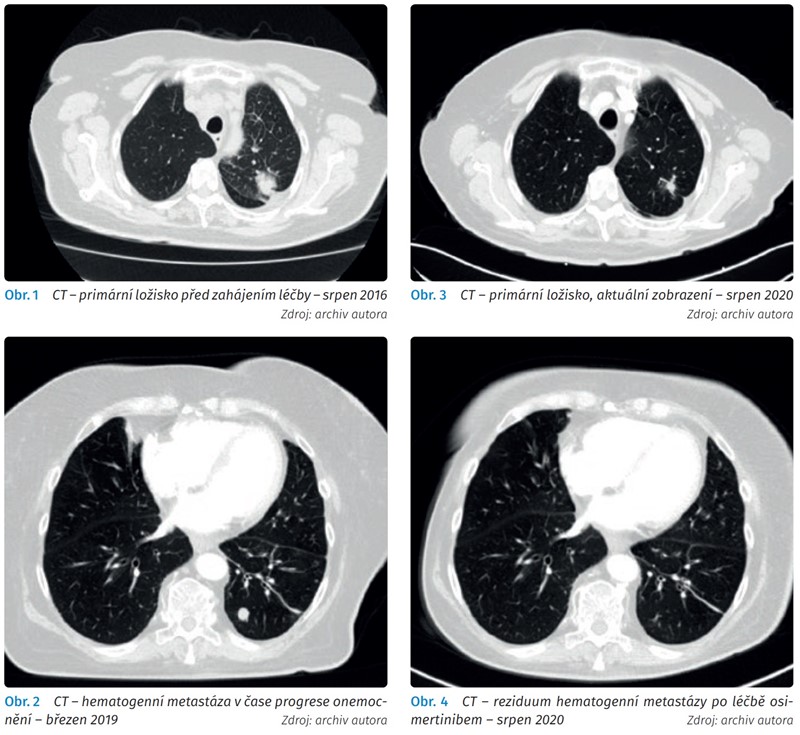
V létě 2016 byla nemocná vyšetřena praktickým lékařem a následně spádovým pneumologem pro suchý dráždivý kašel. Na skiagramu hrudníku byl nález ložiskového stínu v levém horním plicním poli. Následně v srpnu 2016 vyšetření hrudníku výpočetní tomografií (computed tomography, CT) potvrdilo ložisko maligního charakteru v segmentu 1/2 levé plíce velikosti 27 x 23 x 36 mm s levostrannou hilovou a mediastinální lymfadenopatií (obr. 1). Bronchoskopický nález ukázal významné extramurální stenózy v B1 + 2, B3, B6 a B8 vlevo. Byla odebrána aspirační cytologie 3x z B1 + 2 vlevo, 3x z B6 vlevo a 3x z B8 vlevo. Cytologický nátěr na sklíčko v prvním čtení byl hodnocen jako nemalobuněčný karcinom, pravděpodobně epidermoidní. Ve druhém čtení byl nález přehodnocen na adenokarcinom. Molekulárně genetické vyšetření prokázalo mutaci genu EGFR, a to deleci v exonu 19. K dovyšetření a terapii byla pacientka odeslána na naše pracoviště.
V rámci stagingových vyšetření jsme provedli CT mozku a ultrazvuk břicha. Obě vyšetření byla bez známek metastatického postižení. Scintigrafie skeletu však prokázala mnohočetné metastázy skeletu (žebra, levá lopatka, oba femury, pánev).
Případ jsme konzultovali na pneumoonkologickém semináři naší kliniky, který diagnózu uzavřel jako generalizovaný primární bronchogenní karcinom, mikromorfologicky adenokarcinom, EGFR pozitivní s delecí v exonu 19, T2a N2 M1b, IV. klinického stadia (podle TNM 7. edice). Pacientka byla v dobrém klinickém stavu (performance status, PS) podle Eastern Cooperative Oncology Group - ECOG PS 1 a splňovala úhradová kritéria pro léčbu tyrosinkinázovými inhibitory, proto byla v říjnu 2016 zahájena perorální léčba afatinibem v dávce 40 mg 1x denně.
Záhy po nasazení léčby však pacientka začala trpět nechutenstvím a průjmy. Její klinický stav se výrazně zhoršil a obtíže vyústily až v nutnost několikadenní hospitalizace na spádovém pneumologickém a interním oddělení v listopadu 2016. Léčba afatinibem byla v tomto období přerušena. Dokumentaci z těchto hospitalizací bohužel nemáme k dispozici. Následně byla pacientka pro špatný klinický stav přeložena na lůžka následné péče, kde setrvala až do prosince 2016. Vlivem aktivního přístupu rodiny a rehabilitační péče se však klinický stav pacientky průběžně zlepšoval. Zpočátku byla schopna chůze s dopomocí a následně i samostatně s jednou francouzskou holí. Rodinou byl vyjednán pobyt v domě s pečovatelskou službou. V čase propuštění z léčebny dlouhodobě nemocných byl stav pacientky PS 2 podle ECOG.
Do naší ambulance se dostavila na kontrolu v lednu 2017 k rozhodnutí o další onkologické léčbě. Klinicky byla pacientka v uspokojivém stavu - PS 1 podle ECOG a na kontrolním skiagramu došlo k parciální regresi plicního ložiska. Z těchto důvodů bylo doporučeno pokračování v léčbě tyrosinkinázovými inhibitory. Nemocná další léčbu afatinibem odmítala, a proto byla převedena na gefitinib v dávce 250 mg 1x denně. Vzhledem k mnohočetnému metastatickému postižení skeletu byl rovněž nasazen denosumab v dávce 120 mg s.c. každé 4 týdny a substituce vápníku s vitamínem D3. Takto nastavená léčba byla pacientkou dobře tolerována. Z nežádoucích účinků měla pouze mírnou vyrážku a občasné průjmy reagující na loperamid.
První kontrolní CT vyšetření hrudníku po zahájení terapie s gefitinibem bylo provedeno v červenci 2017. Ve srovnání s diagnostickým CT ze srpna 2016 došlo k regresi tumoru, nicméně oproti CT angiografii ze srpna 2016 byl nález v progresi. Nález byl ke druhému čtení prezentován na mezioborovém indikačním semináři plicní kliniky, kde bylo měření velikosti tumoru při angiografickém vyšetření zpochybněno kvůli přítomnosti městnání v malém oběhu a pleurálního výpotku splývajícího s ložiskem. Indikační seminář zhodnotil účinek léčby jako parciální regresi a bylo doporučeno pokračování ve stávající terapii. Druhé kontrolní CT vyšetření hrudníku bylo provedeno v lednu 2018 a popisovalo další parciální regresi plicního tumoru.
V rámci kontroly v březnu 2018 si pacientka začala stěžovat na intermitentní bolesti levé kyčle. Byla indikována kontrolní scintigrafie, která však neprokázala progresi metastatického postižení kostí. Naopak. Metastatické změny skeletu byly popisovány jako „méně četné a méně výrazné“ ve srovnání se vstupním vyšetřením. Do další ambulantní kontroly s výsledkem scintigrafického vyšetření bolesti spontánně vymizely.
V rámci kontroly v září 2018 byl nově na skiagramu hrudníku patrný obláčkovitý stín velikosti 8 mm parakardiálně vlevo v dolním plicním poli s navazující ploténkovou atelektázou. Následné kontrolní CT vyšetření hrudníku popisovalo v levém dolním plicním laloku pět ložiskových stínů do velikosti 6 mm v kombinaci s jizevnatými změnami. Primární ložisko bylo však v další parciální regresi. Vzhledem k lokalizaci do jednoho plicního laloku a nepřítomnosti jiných nových ložiskových změn byl onkologem nález vyhodnocen jako spíše pozánětlivého charakteru než progrese karcinomu. Pokračovali jsme ve stávající léčbě a měli jsme v plánu časné kontrolní vyšetření CT počátkem roku 2019. Zároveň jsme odebrali tekutou biopsii k dovyšetření možné přítomnosti rezistentních mutací genu EGFR, která však prokázala pouze původní deleci v exonu 19 genu EGFR.
Další cyklus restagingových vyšetření byl proveden na přelomu února a března 2019. Vyšetření hrudníku CT popisovalo stacionární primární plicní tumor i stacionární počet a velikost kostních metastáz (obr. 2). Došlo však k progresi počtu i velikosti ložisek v dolním laloku levé plíce, která byla nově radiologem popisována jako hematogenní metastázy. Kontrolní scintigrafie skeletu nově prokázala ložiskovou patologii v epifýze femuru vlevo (v místě intermitentní bolestivosti v březnu 2018). Jednalo se tedy o zřejmou progresi onemocnění a léčba gefitinibem byla po 27 měsících ukončena.
Před rozhodnutím o léčbě 2. linie byla znovu nadnesena otázka možné přítomnosti rezistentní mutace EGFR. Pro zvýšení výtěžnosti bylo naším záměrem získat biologický materiál z progredujících hematogenních metastáz. Ty však byly endoskopicky nepřístupné a pro transparietální punkci příliš malé. Jedinou možností by byla chirurgická biopsie cestou videoasistované torakoskopie, která se nám ale vzhledem k fragilitě pacientky zdála příliš invazivní. Připadala v úvahu i možnost biopsie primárního tumoru, jenž však byl dlouhodobě velikostně stacionární. Nakonec jsme se museli smířit s opakováním tekuté biopsie. Toto vyšetření prokázalo jak známou aktivační mutaci genu EGFR v exonu 19, tak nově rezistentní mutaci genu EGFR v exonu 20 (c.2369C>T, p.Thr790Met, tzv. T790M). Pacientka byla dlouhodobě v dobrém klinickém stavu PS 1 podle ECOG, proto jsme u ní v dubnu 2019 zahájili terapii tyrosinkinázovým inhibitorem 3. generace osimertinibem v dávce 40 mg 1x denně. Pacientka tuto léčbu kromě mírné vyrážky tolerovala velmi dobře. Jiné nežádoucí účinky se u pacientky nevyskytly.
V následujícím období jsme pro progresi bolestivosti levé kyčle ošetřili kostní metastázu femuru paliativní radioterapií do celkové dávky 30 Gy, která měla uspokojivý analgetický účinek. U pacientky jsme po celou dobu léčby aplikovali denosumab. Následující kontrolní CT vyšetření v listopadu 2019 a recentně v srpnu 2020 prokázala místy parciální a místy kompletní regresi hematogenních metastáz. Ostatní nález zůstává stacionární (obr. 3 a 4). Pacientka je v čase psaní této kazuistiky léčena osimertinibem 18 měsíců a její kvalita života je výborná.
ZÁVĚR
Kazuistika popisuje případ 78leté pacientky s EGFR pozitivním adenokarcinomem, u které jsme sekvencí tyrosinkinázových inhibitorů 1., 2. a 3. generace dosáhli doposud 45 měsíců trvajícího přežití s dobrou tolerancí léčby.
Práce byla podpořena výzkumným projektem Univerzity Karlovy PROGRES Q28 - Onkologie.
LITERATURA
- Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice. Verze 7.0 [online]. Masarykova univerzita, 2005. Dostupné na: http://www.svod.cz (cit. 2020-11-04)
- Petruželka L, Votruba J. Karcinom plic. 2. rozšířené vydání. Praha: Farmakon Press, 2019.